11.苯与芳香烃 芳香烃亲电取代
- 格式:doc
- 大小:24.50 KB
- 文档页数:2



第11章苯和芳香烃芳香亲电取代反应一、选择题1.下列化合物最难发生氧化反应的是()。
A.苯酚B.甲苯C.苯【答案】C【解析】苯具有芳香性难氧化。
2.下列化合物酸性最小的是()。
【答案】C3.下列结构具有芳香性质的是()。
【答案】C4.下列化合物或离子中有芳香性的是()。
【答案】C5.下列化合物在进行一元硝化时,相对反应速率最快的是()。
【答案】D6.下列化合物不具有芳香性的是()。
【答案】D7.下列化合物中不能发生Friedel-Crafts alkylation反应的是()。
A.对二甲苯B.苯磺酸C.苯甲醚D.异丙苯【答案】B8.下列化合物、离子中有芳香性的是()。
十万种考研考证电子书、题库视频学习平台圣才电子书【答案】B9.苯乙烷被高锰酸钾氧化得到的主要产物是()。
A.苯乙酸B.苯甲酸C.苯甲醇D.苯乙醇【答案】B 10.下列芳香族化合物中,在苯环上发生亲电取代反应速率最快的是()?【答案】(b)二、填空题1.比较下列化合物与反应的活性大小。
【答案】A>C>B2.【答案】【解析】第一步为芳烃的侧链氧化反应;第二步为芳烃的亲电取代(连有间位定位基);第三步为羧酸成酰氯的反应;第四步为酰氯成酐的反应。
3.【答案】;Zn/HCI(或者H2NNH2-NaOH/二缩乙二醇醚或者乙硫醇/H2/Raney Ni);CH3COCl/AlCl3;【解析】第一步是芳烃的付-克酰基化反应,第二步是羰基还原成亚甲基,第三步又是芳烃的付-克酰基化反应,第四步为甲基酮的碘仿反应。
4.。
【答案】5.。
【答案】三、简答题1.用苯、乙酰乙酸乙酯以及两个碳以内的有机物为原料合成答:2.用苯和两个碳以内的有机物为原料合成甲基橙。
答:3.用苯和两个碳以内的有机物为原料合成化合物答:4.为什么萘剧烈氧化生成邻苯二甲酸酐后,不易再进一步被氧化?2-萘胺被氧化生成什么产物?答:因为邻苯二甲酸酐相当于苯环上连接两个强的吸电子基,使苯环上电子云密度降低,故不易再进一步被氧化。

第11章苯和芳香烃芳香亲电取代反应一、选择题1.下面的化合物进行硝化反应的速度顺序是()。
[华中科技大学2000研]A.(3)>(4)>(2)>(1)B.(3)>(2)>(4)>(1)C.(4)>(2)>(3)>(1)D.(4)>(3)>(1)>(2)【答案】A【解析】给电子基的给电子能力越强,苯环上的硝化反应越快;吸电子基的吸电子能力越强,硝化反应越慢。
2.下面化合物的正确名称是()。
[华中科技大学2000研]A.对甲基苯磺酰胺B.N-甲基对甲苯磺酰胺C.对甲苯甲基苯磺酰胺D.甲氨基对甲苯磺酰胺【答案】B【解析】取代基中含磺酰胺基,要以苯磺酰胺作为主体命名。
3.苯甲醚在邻位进行硝化反应时,其中间体的极限结构对共振杂化体贡献最大的是()。
[天津大学2000;大连理工大学2004研]【答案】C【解析】(C)中的正电荷位于与甲氧基相连的碳原子上,甲氧基的给电子效应使正电荷分散,因此该极限结构比其他三种极限结构相对稳定,对共振杂化体的贡献最大。
4.反应的主要产物是()。
[武汉大学2001研](D)(A),(B)等量(E)(A),(C)等量【答案】B【解析】氯原子为邻、对位定位基,因生成(A)时的空间位阻较大,故主要产物为(B)。
5.下列化合物,芳环上起亲核取代反应速率最快的是()。
[南京大学2003研]【答案】C【解析】与氯原子相连的碳原子带的正电荷越多,则亲核取代反应速率越快。
硝基为吸电子基,使苯环上邻、对位电子云密度降低,正电荷增多,故(C)亲核反应速率最快。
6.下列化合物有芳香性的是()。
[华中科技大学2000研]【答案】B,C【解析】(B)项分子中有6个π电子,符合休克尔规则;(C)项中的七元环带一个单位正电荷,五元环带一个单位负电荷,这样七元环和五元环的π电子数都为6个,且在同一平面内,都符合休克尔规则。
7.下列化合物中有芳香性的是()。
[中国科学院-中国科学技术大学2001研]【答案】A【解析】(A)中有10个π电子数,符合休克尔规则。


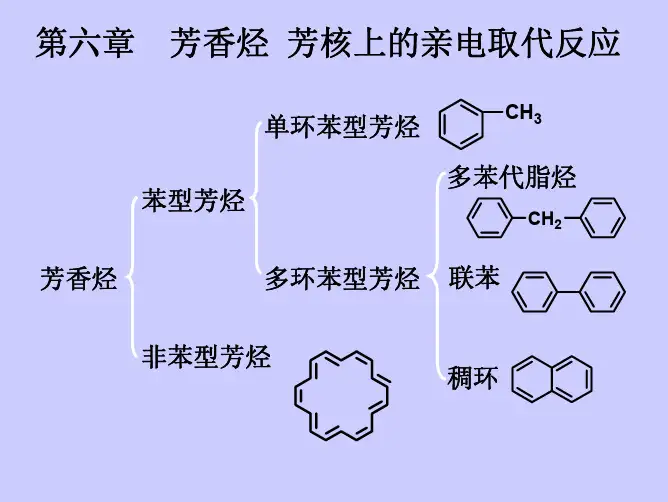
第七章苯和芳香烃一.苯的结构二.芳香烃的分类和命名三.物理性质四.苯及其同系物的化学性质五.苯环上取代基的定位效应及规律六.定位效应在有机合成中的应用七.稠环芳烃八.联苯和多苯代脂烃芳香化合物的定义第一阶段:从植物胶中取得的具有芳香气味的物质称为芳香化合物。
第二阶段:将苯和含有苯环的化合物称为芳香化合物。
第三阶段:将具有芳香特性的化合物称为芳香化合物。
芳香烃:含有苯环(包括苯和苯的衍生物)或者结构和苯不同,但性质与苯相似的一大类非苯芳香族化合物。
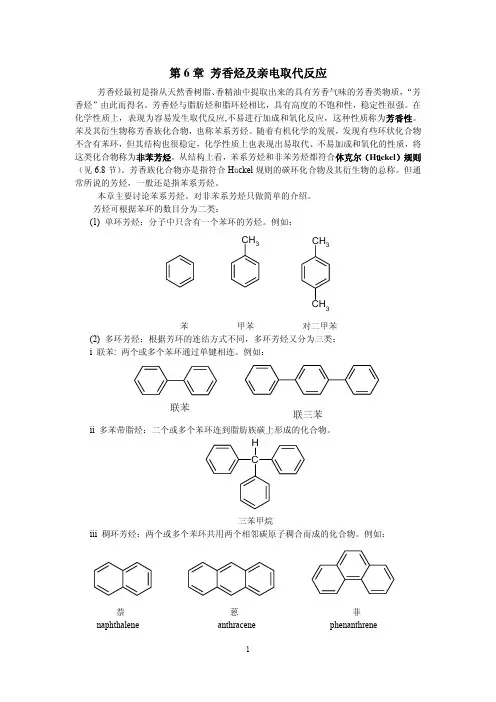
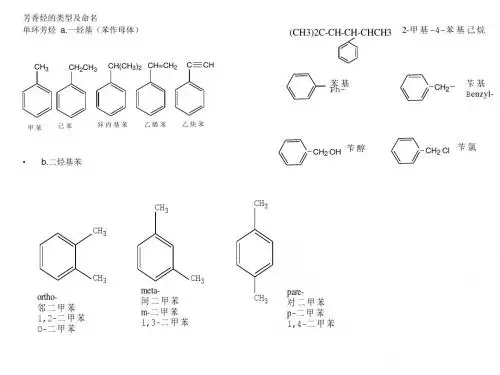
芳香烃单环芳烃—只含有一个苯环:多苯代脂烃:多环芳烃:联苯类:稠环芳烃:CH3HC CH2CHCHCH苯型芳香烃非苯型芳香烃:N N OH分类:一. 苯的结构1. Kekule式19世纪初, 人们发现了这种物质;1825年, 法拉第测定苯的经验式为CH;1833年, Mitcherlish确立苯的分子式为C6H6;此后, 人们对苯的物理性质和化学性质有较充分的认识实验事实:易取代,不易加成一取代产物只有一种邻位二取代产物只有一种疑问: 1. 根据分子式, 苯应是一个高度不饱和的烃, 应表现出不饱和烃的典型反应, 易加成, 而实验事实却相反, 为什么?2. 一取代产物只有一种, 说明6个H 等同.1865年, Kekule 首先提出苯的结构是C-C 链首尾相连的环状结构, 环中三个单键, 三个双键相间, 每个碳和一个氢相连。
这种结构6个H等同,一取代产物只有一种;HH H HH H 简写为:而邻位二取代产物A 中与两个取代基相连的两个碳之间是双键;B 中与两个取代基相连的两个碳之间是单键,故A 与B 是不同的。
A B Kekule 提出苯中的双键没有固定的位置,它在不停的摆动,因此不能分出两个邻二卤代物,实际上它们是等同的X X X X X X XXH2119.5kJ/mol3H2按Kekule式,应为119.5×3= 358.5kJ/mol实际ΔH=208.2kJ/molΔE=358.5-208.2=150.3kJ/mol疑问:1.苯比环己三烯稳定, Kekule不能解释;2.根据Kekule式, 苯是环己三烯结构的, 高度不饱和,为什么不易发生加成, 反而易取代呢?2. 苯的结构sp 2H H H H H H 近代化学键的电子理论指出:(1)苯环上所有原子都处在同一平面上;(2) 6个C 都是sp2杂化,每个碳都以3个sp2杂化轨道分别与2个C 和1个H 结合形成三个σ键;(3) 余下的6个p 轨道都垂直于此平面,相互平行,彼此侧面交叠形成一个封闭的大π键,使π电子高度离域,达到完全平均化,故苯环中6个C-C 键长完全相等,无单、双键之分。


高二化学芳香烃知识点1、亲电取代反应芳香烃图册主要包含五个方面:卤代:与卤素及铁粉或相应的三卤化铁存在的条件下,可以发生苯环上的h被取代的反应。
卤素的反应活性为:f>cl>br>i不同的苯的衍生物发生的活性是:烷基苯>苯>苯环上有吸电子基的衍生物。
烷基苯出现卤代的时候,如果就是上述催化剂,可以出现苯环上h替代的反应;例如在光照条件下,可以出现侧链上的h被替代的反应。
应用:鉴别。
溴水或溴的四氯化碳溶液如:鉴别:苯、己烷、苯乙烯。
答案:step1:溴水;step2:溴水、fe粉。
硝化:与浓硫酸及浓硝酸混酸存有的条件下,在水浴温度为55摄氏度至60摄氏度范围内,可以向苯环上导入硝基,分解成硝基苯。
相同化合物出现硝化的速度同上。
磺化:与浓硫酸发生的反应,可向苯环引入磺酸基。
该反应是个可逆的反应。
在酸性水溶液中,磺酸基可脱离,故可用于基团的保护。
烷基苯的磺化产物随温度变化:高温时主要得到对位的产物,低温时主要得到邻位的产物。
f-c烷基化:条件就是浓硫酸alx3等lewis酸存有的情况下,苯及衍生物可以与rx、烯烃、醇出现烷基化反应,向苯环中导入烷基。
这就是个可逆反应,常分解成多元替代物,并且在反应的过程中可以出现c正离子的重排,常常不能获得须要的产物。
该反应当苯环上相连接存有喷电子基团时无法展开。
例如:由苯制备甲苯、乙苯、异丙苯。
f-c酰基化:条件同上。
苯及衍生物可与rcox、酸酐等发生反应,将rco-基团引入苯环上。
此反应不会重排,但苯环上连接有吸电子基团时也不能发生。
如:苯合成正丙苯、苯乙酮。
亲电取代反应活性小结:相连接给电子基的苯替代物反应速度大于苯,且相连接的给电子基越多,活性越大;恰好相反,相连接喷电子基的苯替代物反应速度大于苯,且相连接的喷电子基越多,活性越大。
2、加成反应与h2:在催化剂pt、pd、ni等存有条件下,可以与氢气出现加成反应,最终分解成环己烷。
与cl2:在光照条件下,可以出现自由基加成反应,最终分解成六六六。
芳香类化合物是指从植物胶里取得的具有芳香气味的物质。
现在人们把具有下列特殊稳定的不饱和环状化合物称为方向化合物: (1)从结构上看①芳香化合物一般都具有平面或接近平面的环状结构②键长趋于平均化③具有较高的C/H 比(2)从性质上看①芳香化合物的芳环一般都难以氧化、加成②而易于发生亲电取代反应③具有特殊的光学性质,如芳环环外氢的化学位移处于NMR 低场,而环内氢处于高场等。
上述这些特点被称为芳香性。
1. 芳香烃的结构1.1苯的结构和表达 1.1.1苯的结构第十一章 苯和芳香烃 芳香亲电取代反应120º108pm140pm1.1.2苯的芳香性环己烯的氢化热ΔH=-120kJ/mol,1,3-环己二烯的氢化热ΔH=-232kJ/mol(由于其共轭双键增加了其稳定性)。
而苯的氢化热ΔH=-208kJ/mol。
1,3-环己二烯失去两个氢变成苯时,不但不吸热,反而放出少量的热量。
这说明:苯比相应的环己三烯类要稳定得多,从1,3-环己二烯变成苯时,分子结构已发生了根本的变化,并导致了一个稳定体系的形成。
苯难于氧化和加成,而易于发生亲电取代反应,与普通烯烃的性质有明显的区别。
1.2.3苯的表达自1825年英国物理学家和化学家Farady M(法拉第)首先从照明气中分离出苯后,人们一直在探索苯结构的表达式。
科学家们提出了各种有关苯结构式的假设;其中比较有代表性的苯的结构式有:凯库勒式双环结构式棱形结构式向心结构式对位键结构式余键结构式(凯库勒(杜瓦(拉敦保格(阿姆斯特朗、拜耳(克劳斯(悌勒1865年提出)1866-1867年提出)1869年提出)1887-1888年提出)1888年提出)1899年提出)用内部带有一个圆圈的正六边形表示苯,圆圈强调了π电子的离域作用和电子云的均匀分布,它很好地说明了碳碳键键长的均等性和苯环的完全对称性,但是这种方式用来表示其他方向体系时就不合适了,例如表示萘时很容易造成误解,因为萘不是完全对称的分子,萘分子的碳碳键长也不是完全均等的。
Benzene and aromatics aromatic electrophilic substitution reactions
芳香烃的物理性质
溶于大部分有机溶剂,不溶于水。
对称构型有利于mp的提升。
芳香烃的加成反应
菲,蒽的氧化反应:9,10位优先被加成。
芳香烃的还原反应
Birch还原:苯环被还原为1,4 —环己二烯类化合物。
另外,与苯环共轭的双键先于苯环大π键参与Birch还原。
芳香烃的氢化还原:菲,蒽的还原H2加成反应首先在9,10位发生。
芳香烃的氧化反应
1.苯的氧化反应:烷基取代的苯易被氧化,而且取代烷基无论有多长,只要与苯环相连的C上有H,那么就会被氧化为羧基。
较长的碳链优先被氧化。
换一种情况:与苯环连接的是三级碳原子或者极其稳定的基团,那么在强烈的氧化环境下,苯环优先被氧化。
2.萘的氧化反应:有取代基的情况:如果取代基为活化基团,那么同环被氧化。
如果是钝化基团,那么异环被氧化。
3.菲,蒽的氧化反应:9,10位优先被氧化。
苯环上的芳香亲电取代反应
芳香亲核取代反应的定义:亲电试剂首先对芳香烃进行加成,然后再脱去H的一个取代反应。
取代基的定位效应:书本上对此类反应的定位效应的推论依据是中间过渡态粒子的稳定性,中间过渡态粒子越是稳定,则此条途径所占比例越是高!过渡态粒子的稳定性的判断方法是根据共振式中所占有稳定结构的情况个数而定的。
显然,这样的判断是不精确的,只能得出大概的一个结果。
硝化反应:硝酰正离子对苯环进行芳香亲核取代反应。
硝酰正离子的生成:浓硫酸与浓硝酸互相混合,浓硫酸脱去硝酸分子OH—,然后得到NO2+。
卤化反应:在Lewis酸的催化作用下,卤素解离成正离子和负离子,正离子参与亲电取代。
1.氯化,溴化:三氯化铁催化,加热即可。
2.碘化:二(三氟乙酸)芳基铊与碘化钾溶液反应。
3.氟化:Schiemann反应制取。
芳香重氮盐与氟硼酸反应生成氟硼酸盐,加热后得到氮气,三氟化硼,还有我们想要的氟化芳香烃。
磺化反应:发烟硫酸和浓硫酸可以作为磺化反应的试剂。
本反应是可逆的。
F-C烷基化反应:可逆程度大,中间的碳正离子可以重排。
对于卤化烃,烯烃,仅仅需要催化量的催化剂。
对于醇类,环氧乙烷则需要一倍以上的量。
F-C酰基化反应:羰基与AlCl3络合,反应时应该考虑这点,催化剂的催化的量只需要一点儿。
本反应可逆程度极小,配合Clemmensen还原反应,可以做到和烷基化一样的效果:在苯环上添加碳链。
Addition:间位定位基使得F-C烷基化,酰基化不易发生。
氯甲基化&&Gattermann-Koch反应
氯甲基化:HCl和甲醛作用,得到氯化羟甲基鎓,参与亲电加成,在脱去质子得到氯甲基化产物。
Gattermann-Koch 反应:AlCl3催化,CO与HCl形成中间体——甲酰基正离子,这个粒子对苯环亲电加成,脱去质子,得到甲酰基化产物。
既然本反应是亲电取代反应就必然遵从亲电加成的规则。
苯环上的多元亲电取代的经验规则
1.活化基团的定位作用使起主导作用的!
2.强活化基团定位作用优先于弱活化基团!
3.定位基团能力无大差别则得到不明比例的混合物!
磺基保护位子:利用磺化反应给苯环接上磺基,用磺基占据这个位子,不让其他基团来到这个位子反应,最后利用磺化反应的可逆性脱去磺基。
位阻效应排挤邻位:拿苯胺来说,用乙酰基团去取代—NH2,使得氨基的邻位反应受到阻碍。
萘蒽菲的亲电取代反应
萘的亲电取代反应:α位是动力学控制的,β是热力学控制的。
第一取代基在α位,同环邻对位是反应点。
第一取代基在β位,同环邻位是反应点,6号为也是反应点。
钝化基团使得环钝化,反应点是6,7位。
蒽和菲优先反应点是9,10位。
(ps:感觉这个小节用途不大,知道了点儿皮毛)
Huckel规则:对共平面封闭共轭体系来说,具有(4n+2)个π电子的分子,可能具有特殊芳香稳定性。
芳香性广泛的含义为:
1.分子必须是共平面的封闭共轭体系;
2.键发生了平均化;体系较稳定(有较大的共振能);
3.从实验看,易发生环上的亲电取代反应,不易发生加成反应;
4.在磁场中,能产生感磁环流;
5.从微观上看,π电子数符合4n+2规则。
Written By Rex。