14第9章重量分析法及小结全解
- 格式:ppt
- 大小:1.09 MB
- 文档页数:77







第九章 重量分析法思考题与习题1. 沉淀重量法中,对沉淀形式和称量形式的要求?答:①对沉淀形式的要求:溶解度小;易过滤、洗涤;纯度高;易转化为称量形式。
②对称量形式的要求:有确定的化学组成;稳定,不受空气中水分、CO 2和O 2等的影响;称量形式的摩尔质量要大。
2. 简述获得晶形沉淀和无定形沉淀的主要条件。
答:①晶形沉淀的条件:“稀、热、慢、搅、陈”。
②无定形沉淀的条件:“浓、热、快、稀、再’。
3. 为了使沉淀完全,必须加入过量沉淀剂,为什么不能过量太多?答:在沉淀法中,由于沉淀剂通常是强电解质,所以在利用同离子效应保证沉淀完全的同时,还应考虑盐效应的影响,盐效应使沉淀溶解度增大。
有时还应考虑酸效应、配位效应等的影响。
4. 影响沉淀纯度的因素有哪些?简述提高沉淀纯度的措施。
答:影响沉淀纯度的因素主要有两个:共沉淀和后沉淀。
共沉淀包括:表面吸附、混晶、吸留与包藏。
提高沉淀纯度的措施有:选择合理的分析步骤 、降低易被吸附杂质离子的浓度、选择合适的沉淀剂、选择合理的沉淀条件、必要时进行再沉淀等。
5. 计算下列换算因数称量形式 被测组分(1) Al 2O 3 Al(2) BaSO 4 (NH 4)2Fe(SO 4)2·6H 2O(3) Fe 2O 3 Fe 3O 4(4) BaSO 4 K 2SO 4 ·Al 2 (SO 4)3·24H 2O(5) Mg 2P 2O 7 MgO(6) PbCrO 4 Cr 2O 3解:(1) (2) (3) (4) 23AlAl O 2M M ()()444222BaSO NH Fe SO 6H O 2M M 3423Fe O Fe O 2M M ()4242423BaSO K SO Al SO 24H O 4M M(5) (6) 6. 称取0.7089g 不纯的KCl 试样,以过量的AgNO 3处理,得到1.3028gAgCl ,求该试样中KCl 的百分含量。

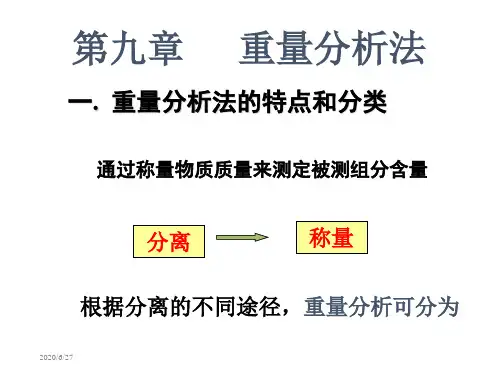
重量分析法第一节重量分析法的一般步骤和特点第二节重量分析对沉淀的要求第三节沉淀的形成第四节影响沉淀纯度的因素第五节沉淀的操作条件第六节重量分析的计算和示例重量分析法(gravimetric analysis)是采用适当的方法,使被测组分与试样中的其它组分分离,转化为一定的称量形式,然后用称重的方法测定该组分的含量。
重量分析法包括化学沉淀法、汽化法、电解法、萃取法等。
通常重量分析指的長化学沉淀法,以沉淀反应为基础,根据称量反应生成物的重量来测定物质含量。
第一节重量分析法的一般步骤和特点重量分析法的一般步骤为:试样f试液f沉淀形式f称量形式f计算结果。
试样经适当步骤分解后,制成含被测组分的试液。
加入沉淀剂后,得到含被测组分的沉淀形式。
经过滤、洗涤、灼烧或干燥,得到称量形式。
根据称量形式可以进行重量分析结果计算。
一、重量分析法的一般步沉淀形式和称量形式可以相同,也可以不同。
二、重量分析法的特点重量分析法直接用分析天平称量获得分析结果,不需基准物质或标准试样作为参比,分析结果的准确度较高,一般测定的相对误差不大于0. 1%O重量分析不足之处長操作繁琐,费时较多,对低含量组分的测定误差较大,所以不适于生产中的控制分析和微量组分的测定。
高含量的硅、磷、铸、稀土元素等试样的精确分析,至今仍然使用重量分析法。
第二节重量分析对沉淀的要求一、对沉淀形式的要求1、沉淀的溶解度要小,使被测组分能定量沉淀完全;2、沉淀要纯净,尽量避免混进杂质;3、沉淀应是粗大的晶形沉淀,易于过滤、洗涤。
对于非晶形沉淀,必须选择适当的沉淀条件,使沉淀结构尽可能紧密。
4、沉淀经干燥或燃烧后,易于得到组成恒定、性质稳定的称量形式.二、对称量形式的要求1、化学组成恒定,符合一定化学式,这是对称量形式最重要的要求。
2、称量形式要稳定,不易吸收空气中的水分和二氧化碳,在干燥、灼烧时不易分解,否则不适于用作称量形式;3、摩尔质量尽可能大,少量的待测组分可以得到较大量的称量物质,因而提高分析灵敏度,减小称量误差.三、对沉淀剂选择的要求1、具有较好的选择性,即要求沉淀只能与待测组分生成沉淀,而与试液中的其他组分不起作用。

