山东大学期末考试复习 水分析化学[第二章酸碱滴定法]山东大学期末考试知识点复习
- 格式:docx
- 大小:326.63 KB
- 文档页数:14

第三章配位滴定法一、配位滴定法概述配位滴定是以配合反应为基础的滴定分析方法。
它以配位剂作标准溶液直接或间接地滴定被测溶液,形成配位化合物,并选用适当的指示剂确定滴定终点。
--等和有机配位剂如氨羧配位、用于配位滴定的配位剂:无机配位剂如CNF 剂使用较广泛:氨基三乙酸(NTA) 乙二胺四丙酸(EDTD) 乙二胺四乙酸(EDTA)EDTA的性质及配合物二、 EDTA的离解平衡 1.2+相TA这样EDY的两个羧酸根可再接受质子,形成HY—,在强酸溶液中,H64级离解平衡当于一个六元酸,有6O Y+2HHEDTA具有中强二元酸的性质-- HY+2NaOH====Na 可见,2224:3—1)表EDTA在水溶液中有七种存在型体(4-2--+2+3-] +[HY]+[YY[HY[HY][HY[HY[HY)C(H=]+]++]+]2344651表值下的主要存在型体在不同 EDTApH 3—4- 4- 1。
Y的分布分数δ pH≥12时,只有Y≈型体,此时y4-,难溶于酸和一般有℃)/100mL水(22 EDTA微溶于水,其溶解度为0.02g2 Y·也简称EDTA(NaH 机溶剂,易溶于氨水和氢氧化钠溶液。
故常用它的二钠盐,22;L3mol/℃(22),浓度为0.,其溶解度为,M=372.24)11.2g/100mL水OH2 8。
值为溶液的pH4.0.01mol/L EDTA EDTA与金属离子形成的配合物的特点 2.EDTA1;配合物稳定;配合物易溶于水;配位性广泛;配位比简单的为1:与无色的金属离子生成无色配合物,与有色金属离子生成更深的配合物。
三、配合物在溶液中的离解平衡.配合物的稳定常数 1 1型配合物时:1与配合剂(L)形成:(M) 金属离子θθ越大,K对于相同配位数的配离子,K值越大,该配离子在水中越稳定,df表示配离子越易离解。
:形成与配合剂金属离子 (M)(L)1n型配合物时:θ K表示。


分析化学酸碱滴定法分析化学中的酸碱滴定法是一种常用的定量分析方法,广泛应用于各种领域,包括环境监测、制药、食品检验等。
该方法通过在化学反应中加入一种已知浓度的酸或碱溶液,利用滴定终点的指示剂的颜色变化或电动势的变化来确定待测溶液的浓度。
酸碱滴定法的基本原理是酸和碱反应的定量关系:n1V1=n2V2,其中n1和n2分别是酸和碱的摩尔数,V1和V2分别是酸和碱的体积。
根据这一关系,可以确定待测溶液中酸或碱的浓度。
在酸碱滴定法中,滴定终点的判断是关键步骤。
常用的指示剂有酚酞、溴酸甲基橙、甲基红等,其颜色在酸碱反应过程中发生明显变化。
当滴加的酸或碱溶液足够与待测溶液中的酸或碱反应到足够数量时,指示剂的颜色发生转变,即达到了滴定终点。
酸碱滴定法有以下几个主要步骤:1.准备滴定溶液:根据待测溶液的性质选择合适的酸或碱溶液作为滴定溶液,调整其浓度,使其能够反应到滴定终点。
2.准备待测溶液:将待测溶液取出一定容积,用烧杯或容量瓶装放。
3.添加指示剂:根据待测溶液的酸碱性质选择合适的指示剂,加入待测溶液中。
4.滴定:用滴定管将滴定溶液滴加到待测溶液中,直到指示剂颜色发生转变,即达到滴定终点。
5.计算结果:根据酸碱反应的定量关系,使用酸碱滴定公式计算出待测溶液中酸或碱的浓度。
酸碱滴定法的优点是操作简单,结果准确可靠。
然而,该方法也有一些局限性。
首先,滴定终点的判断具有主观性,可受到操作人员的视力、光线等因素的影响。
其次,在滴定过程中,应该严格控制滴加速度,以避免溅液影响滴定结果。
此外,滴定终点对于复杂样品或多种酸碱的滴定来说可能会出现困难。
为了提高酸碱滴定法的准确性和灵敏度,人们引入了一些改进方法,如自动滴定器和电位滴定法。
自动滴定器可以自动控制滴加速度和滴定终点的判断,减少了人为误差。
电位滴定法则通过跟踪滴定过程中的电位变化来确定滴定终点,提高了滴定方法的精确性。
总之,酸碱滴定法是一种常用的分析化学方法,其简单易行、结果可靠的特点使其得到广泛应用。

第二章酸碱滴定法一、选择题1. 在水溶液中共轭酸碱对K a与K b的关系是------------------( )(A) K a·K b=1 (B) K a·K b=K w(C) K a/K b=K w(D) K b/K a=K w2. HPO42-的共轭碱是-----------------------------------( )(A) H2PO4-(B) H3PO4(C) PO43- (D) OH-3. 浓度相同的下列物质水溶液的pH最高的是-----------( )(A) NaCl (B) NaHCO3 (C) NH4Cl (D) Na2CO34. 相同浓度的CO32-、S2-、C2O42-三种碱性物质水溶液, 其碱性强弱(由大至小)的顺序是-----------------( )(已知H2CO3:p K a1 = 6.38,p K a2 = 10.25;H2S:p K a1 = 6.88 ,p K a2 = 14.15;H2C2O4:p K a1 = 1.22,p K a2 = 4.19 )(A) CO32->S2->C2O42-(B) S2->C2O42->CO32- (C)S2->CO32->C2O42-(D) C2O42->S2->CO32-5. 在H2C2O4溶液中,下列活度系数的排列顺序正确的是---------------( )(A) γ(HC2O4-) > γ(H+) > γ(C2O42-) (B) γ(H+) > γ(HC2O4-) >γ(C2O42-)(C) γ(C2O42-) > γ(HC2O4-) > γ(H+) (D) γ(HC2O4-) > γ(C2O42-) >γ(H+)6. 六次甲基四胺[(CH2)6N4]缓冲溶液的缓冲pH范围是---------( )⎨p K b[(CH2)6N4] = 8.85⎬(A) 4~6 (B) 6~8 (C)8~10 (D) 9~117. 在一定的温度下,活度系数与水合离子半径的关系是水合离子半径愈大,离子的活度系数-----------( )(A) 愈大(B) 愈小(C) 无影响(D) 先增大后减小8. H2A酸的pK a1= 2.0,pK a2= 5.0。

【化学知识点】酸碱滴定法的原理
1.强酸强碱的滴定:滴定突跃范围大小与浓度有关;
2.强碱滴定弱酸;突跃范围小,计量点在碱性范围内,不能选酸性范围内变色的指示剂,只能选择酚酞或百里酚酞;
3.强酸滴定弱碱:与强碱滴定弱酸相似,但计量点在酸性范围内,指示剂只能选择甲基橙或溴甲酚绿等。
酸碱滴定法是指利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
可用于测定酸、碱和两性物质,是一种利用酸碱反应进行容量分析的方法。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
标定它们的基准物质是碳酸钠。
酸碱滴定法在工、农业生产和医药卫生等方面都有非常重要的意义。
三酸、二碱是重要的化工原料,它们都用此法分析。
在测定制造肥皂所用油脂的皂化值时,先用氢氧化钾的乙醇溶液与油脂反应,然后用盐酸返滴过量的氢氧化钾,从而计算出1克油脂消耗多少毫克的氢氧化钾,作为制造肥皂时所需碱量的依据。
又如测定油脂的酸值时,可用氢氧化钾溶液滴定油脂中的游离酸,得到 1克油脂消耗多少毫克氢氧化钾的数据。
酸值说明油脂的新鲜程度。
粮食中蛋白质的含量可用克氏定氮法测定。
很多药品是很弱的有机碱,可以在冰醋酸介质中用高氯酸滴定。
测定血液中HCO的含量,可供临床诊断参考。
感谢您的阅读,祝您生活愉快。

分析化学期末考试试题(C)一、选择题1. 今欲用Na3PO4与HCl来配制pH = 7.20的缓冲溶液,则Na3PO4与HCl 物质的量之比n(Na3PO4)∶n(HCl)应当是----------------------------------------------------------------------( ) (H3PO4的p K a1~p K a3分别是2.12,7.20,12.36)(A) 1:1 (B) 1:2 (C) 2:3 (D) 3:22. 微溶化合物A2B3在溶液中的解离平衡是:A2B3==2A + 3B。
今已测得B的浓度为3.0×10-3mol/L,则该微溶化合物的溶度积K sp是----------------------------------------------( )(A) 1.1×10-13(B) 2.4×10-13(C) 1.0×10-14(D) 2.6×10-113. 下面四种表述中正确的是------------------------------------------------------------------()(1)绝对误差大,相对误差就一定大(2)绝对误差是正的,相对误差一定为正(3)校正值与绝对误差相等(4)绝对误差为正,校正值一定为负(A)1,2 (B)1,3 (C)2,3 (D)2,44. 欲配制pH =5.0的缓冲溶液,最好选择---------------------------------------------------( )(A) 一氯乙酸(p K a = 2.86) (B) 氨水(p K b = 4.74) (C) 六次甲基四胺(p K b = 8.85) (D) 甲酸(p K a =3.74)5. 可以减小随机误差的方法是-------------------------------------------------------------------( )(A) 对仪器进行校准(B) 做空白试验(C) 增加平行测定次数(D) 做对照试验6. 含0.10mol/L HCl和0.20mol/L H2SO4的混合溶液的质子条件式是------------------( )(A) [H+] = [OH-]+[Cl-]+[SO42-] (B) [H+]+0.3 =[OH-]+[SO42-](C) [H+]-0.3 = [OH-]+[SO42-] (D) [H+]-0.3 =[OH-]+[SO42-]+[HSO4-]7. 测定某有机物,称取0.2000 g, 溶解后加入0.01000 mol/L I2标准溶液10.00 mL,回滴I2时消耗0.01000 mol/L Na2S2O3 19.20 mL,则此测定的相对误差约是------------------( )(A) 千分之几(B) 百分之几(C) 百分之几十(D) 百分之百8. 分析测定中随机误差的特点是----------------------------------------------------------------( )(A) 数值有一定范围(B) 数值无规律可循(C) 大小误差出现的概率相同(D) 正负误差出现的概率相同9. 在含有Fe3+和Fe2+的溶液中, 加入下述何种溶液, Fe3+/Fe2+电对的电位将升高(不考虑离子强度的影响)----------------------------------------------------------------------------------( )(A) 稀H2SO4(B) HCl (C) NH4F (D) 邻二氮菲10. 下列数据中有效数字为二位的是----------------------------------------------------------( )(A)[H+]=10-3.4(B) pH=2.0 (C) lg K=16.5 (D)lg K=16.46二、填空题( 共14题30分)1. 某酸碱指示剂HIn在其有1/5转变成离子形式时发生颜色变化,若颜色变化时的pH = 6.40,试计算指示剂的解离常数K a(HIn),_______________________。
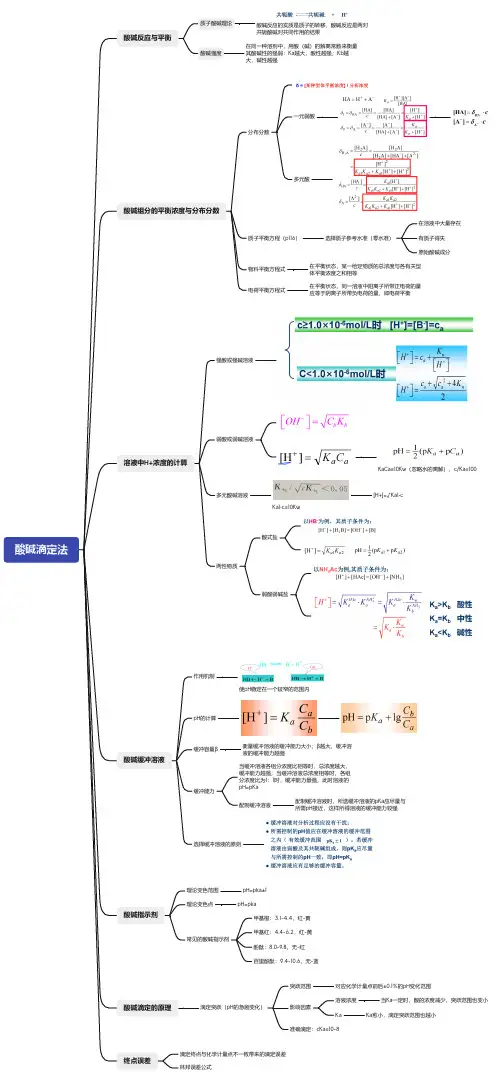
酸碱滴定法酸碱反应与平衡质子酸碱理论酸碱反应的实质是质子的转移,酸碱反应是两对共轭酸碱对共同作用的结果酸碱强度在同一种溶剂中,用酸(碱)的解离常数来衡量其酸碱性的强弱:Ka越大,酸性越强;Kb越大,碱性越强酸碱组分的平衡浓度与分布分数分布分数一元弱酸多元酸质子平衡方程(p116)选择质子参考水准(零水准)在溶液中大量存在有质子得失原始酸碱成分物料平衡方程式在平衡状态,某一给定物质的总浓度与各有关型体平衡浓度之和相等电荷平衡方程式在平衡状态,同一溶液中阳离子所带正电荷的量应等于阴离子所带负电荷的量,即电荷平衡溶液中H+浓度的计算强酸或强碱溶液弱酸或弱碱溶液K aCa≥10Kw(忽略水的离解),c/Ka≥100多元酸碱溶液K a1•c≥10Kw[H+]=√Ka1•c两性物质酸式盐弱酸弱碱盐酸碱缓冲溶液作用机制使pH稳定在一个较窄的范围内p H的计算缓冲容量β衡量缓冲溶液的缓冲能力大小;β越大,缓冲溶液的缓冲能力越强缓冲能力当缓冲溶液各组分浓度比相等时,总浓度越大,缓冲能力越强;当缓冲溶液总浓度相等时,各组分浓度比为1:1时,缓冲能力最强,此时溶液的p H=pKa配制缓冲溶液配制缓冲溶液时,所选缓冲溶液的pKa应尽量与所需pH接近,这样所得溶液的缓冲能力较强选择缓冲溶液的原则酸碱指示剂理论变色范围p H=pka±1理论变色点p H=pka常见的酸碱指示剂甲基橙:3.1-4.4,红-黄甲基红:4.4-6.2,红-黄酚酞:8.0-9.8,无-红百里酚酞:9.4-10.6,无-蓝酸碱滴定的原理滴定突跃(pH的急剧变化)突跃范围对应化学计量点前后±0.1%的pH变化范围影响因素溶液浓度当Ka一定时,酸的浓度减少,突跃范围也变小K a K a愈小,滴定突跃范围也越小准确滴定:cKa≥10-8终点误差滴定终点与化学计量点不一致带来的滴定误差林邦误差公式。
![山东大学期末考试复习 水分析化学[第四章沉淀滴定法]山东大学期末考试知识点复习](https://uimg.taocdn.com/f4c60a46f7ec4afe04a1df08.webp)
第四章沉淀滴定法一、沉淀滴定法是以沉淀反应为基础的滴定分析法通常应用最多的是银量法,银量法主要用于测定水中C1一、Br一、I一、Ag+及SCN一等。
因所用指示剂不同可分为莫尔法(Mohr)、佛尔哈德法(Volhard)、法扬司法(Fajans)三种。
莫尔法:以铬酸钾作为指示剂的银量法称为莫尔法。
本法适用于测定Cl一、Br一和Ag+。
一般控制溶液为中性或弱碱性。
佛尔哈德法:是用铁铵钒即硫酸高铁铵作为指示剂的银量法。
有直接滴定法和返滴定法。
以NH4SCN或KSCN为滴定剂。
佛尔哈德法可用于测定C1一、Br、I 一、Ag+及SCN一。
佛尔哈德法最大的优点是可在酸性溶液中进行滴定,且方法选择性高。
但测定卤素离子时需使用AgNO3和NH4SCN两种标准溶液。
在测定Cl一时,需加入有机溶剂以防止沉淀发生转化反应。
法扬司法:是用吸附指示剂指示滴定终点的银量法。
吸附指示剂是一类有机染料(如荧光黄),在溶液中可离解为具有一定颜色的阴离子,此阴离子容易被带正电荷的胶体沉淀所吸附,从而引起颜色的改变,指示终点到达。
法扬司法可测定Cl、Br一、I一、Ag+及SCN一,一般控制溶液为弱酸性或弱碱性。
法扬司法方法简便,终点明显,但反应条件要求比较严格,应注意溶液的酸度、浓度及胶体的保护等。
二、重量分析法概述1.重量分析法,一般将被测组分与试样中的其他组分分离,转化为一定的称量形式,称量后,计算得出被测组分的含量。
根据被测组分与其他试样分离方法的不同,重量法可分为:沉淀法、气化法、电解法和萃取法。
本章主要介绍沉淀法。
沉淀法是利用沉淀反应使被测组分以沉淀形式析出,通过过滤、洗涤、烘干或灼烧后,称量并计算被测组分的含量。
2.重量分析对沉淀形式和称量形式的要求。
利用沉淀反应,使被测组分以适当的“沉淀形式”析出,过滤、洗涤后再将沉淀烘干或灼烧成为“称量形式”称量。
沉淀形式和称量形式可能相同,也可能不相同。
重量分析对沉淀形式的要求:①沉淀的溶解度要足够小;②沉淀的纯度高;③沉淀易于洗涤和过滤;④沉淀易于转化为具有固定组成的称量形式。


一名词解释1.化学计量点-标准溶液与被测定物质定量反应完全时的那一点,用SP表示。
2.滴定终点-在滴定过程中指示剂正好发生颜色变化的那点称为滴定终点,ep表示。
3.酸效应-这种由于H+的存在,使络合剂参加主体反应的能力降低的效应称为酸效应。
4.条件电极电位:在特定条件下,氧化态和还原态的总浓度Cox=Cred=1mol/或Cox/Cred=1时的实际电极电位。
5.BOD(生物化学需氧量)在规定条件下,微生物分解水中的有机物所进行的生物化学过程中,所消耗的溶解氧的量,单位为mgO2/L。
6.络合物条件稳定常数:在PH外界因素影响下,络合物的实际稳定程度。
K‘稳。
7.络合滴定的主反应:滴定剂EDTA与被测定金属离子形成MY的络合反应。
8络合滴定的副反应:当金属离子M与络合剂Y发生络合反应时,如有共存金属离子N也能与Y发生络合反应,这个反应称为副反应。
一、填空题1.测定某废水中Cl-的含量,五次测定结果分别为50.0,49.8,49.7,50.2和50.1mg/L,则测定结果的相对平均偏差为%。
d(%)=d/x*100对自来水硬度进行测定,结果以mg CaO/L表示,分别为106.4、106.2和106.6,则三次测定的相对平均偏差为%(保留1位有效数字)。
测定自来水中的钙硬度,三次平行测定结果为73.53、73.64和73.36 mg CaO/L,则测定结果的相对平均偏差为。
2.碘量法产生误差的主要原因是、和。
3.由于H+的存在而使EDTA参加主反应的能力的现象,称为。
4.络合滴定的方式有、、、。
5.如果某酸碱指示剂的电离平衡常数为Ka=5.3×10-8,则它的变色范围为。
如果某酸碱指示剂的电离平衡常数为Ka=7.6×10-10,则它的变色范围为,理论变色点为。
某酸碱指示剂的K HIn=1.0×10-5,则它的变色范围为~ ,理论变色点为。
6.请列举常用水质指标、、。
7.莫尔法的pH条件为,而佛尔哈德法的pH条件为。

山大分析化学试题及答案一、选择题(每题2分,共20分)1. 分析化学中,用于测定溶液pH值的仪器是:A. 酸度计B. 滴定管C. 比色计D. 离心机答案:A2. 下列哪种物质不是缓冲溶液?A. 醋酸和醋酸钠B. 碳酸钠和碳酸氢钠C. 硫酸和硫酸钠D. 磷酸和磷酸氢二钠答案:C3. 滴定分析中,滴定终点的判断依据是:A. 滴定体积B. 颜色变化C. 反应速率D. 反应时间答案:B4. 原子吸收光谱法中,测定元素含量的基本原理是:A. 原子吸收光的强度B. 原子发射光的强度C. 原子的荧光强度D. 原子的磷光强度答案:A5. 以下哪种方法不是色谱分析法?A. 气相色谱法B. 液相色谱法C. 质谱法D. 薄层色谱法答案:C6. 以下哪种仪器不是用于样品前处理的?A. 离心机B. 萃取器C. 紫外-可见分光光度计D. 固相萃取柱答案:C7. 原子吸收光谱法中,火焰原子化器的作用是:A. 将样品原子化B. 将样品分子化C. 将样品离子化D. 将样品气化答案:A8. 质谱分析中,用于将样品分子转化为离子的设备是:A. 离子源B. 质量分析器C. 检测器D. 记录器答案:A9. 红外光谱分析中,用于测定分子振动能级的仪器是:A. 红外光谱仪B. 紫外-可见分光光度计C. 核磁共振仪D. 质谱仪答案:A10. 以下哪种物质是常用的表面活性剂?A. 硫酸钠B. 硫酸铵C. 十二烷基硫酸钠D. 硫酸钾答案:C二、填空题(每空1分,共20分)1. 滴定分析中,滴定剂的浓度表示为______。
答案:摩尔浓度2. 缓冲溶液的pH值主要取决于______。
答案:缓冲对的浓度3. 原子吸收光谱法中,样品的原子化方法主要有______和______。
答案:火焰原子化;石墨炉原子化4. 色谱分析中,固定相可以是______、______或______。
答案:固体;液体;气体5. 质谱分析中,样品分子被电离后,通过______进行质量分析。
分析化学期末考试试题(D)一、选择题( 共15题30分)1. 若以甲基橙为指示剂, 用NaOH标准溶液滴定FeCl3溶液中的HCl时,Fe3+将产生干扰。
为消除Fe3+的干扰, 直接测定HCl,应加入的试剂是----------------------------------( )(A) KCN (B) 三乙醇胺(pK b= 6.24)(C) EDTA二钠盐(预先调节pH=4.0) (D) Zn2+-EDTA(预先调节pH=4.0)2. 试液体积在1 ~ 10 mL的分析称为-----------------------------------------------------( )(A) 常量分析(B) 半微量分析(C) 微量分析(D) 痕量分析3. MnO4-/Mn2+电对的条件电位与pH的关系是-----------------------------------------( )(A) '=-0.047pH (B) '=-0.094pH(C) '=-0.12pH (D) '=-0.47Ph4. 用邻苯二甲酸氢钾为基准物标定0.1 mol/L NaOH溶液,每份基准物的称取量宜为[M r(KHC8H8O4)=204.2]------------------------------------------------------------------------( )(A) 0.2 g左右 (B) 0.2 g ~ 0.4 g(C) 0.4 g ~ 0.8 g (D) 0.8 g ~ 1.6 g5 在一定酸度下,用EDTA滴定金属离子M。
当溶液中存在干扰离子N时, 影响络合剂总副反应系数大小的因素是-------------------------------------------------------------------------( )(A) 酸效应系数αY(H)(B) 共存离子副反应系数αY(N)(C) 酸效应系数αY(H)和共存离子副反应系数αY(N)(D) 络合物稳定常数K(MY)和K(NY)之比值6. 当两电对的电子转移数均为2 时, 为使反应完全度达到99.9%, 两电对的条件电位差至少应大于-------------------------------------------------------------------------------------------( )(A) 0.09 V (B) 0.18 V(C) 0.27 V (D) 0.36 V7. 为标定Na2S2O3溶液的浓度宜选择的基准物是---------------------------------------( )(A) 分析纯的H2O2(B) 分析纯的KMnO4(C) 化学纯的K2Cr2O7(D) 分析纯的K2Cr2O78. 含有相同浓度Cu2+的pH = 10.0的氨性缓冲溶液A、B两份。
第五章氧化还原滴定法一、氧化还原平衡氧化还原滴定法是以氧化还原反应为基础的滴定分析法。
广泛地用于水质分析中,例如水中溶解氧(DO)、高锰酸盐指数、化学需氧量(COD)、生物化学需氧量(BOD520)及饮用水中剩余氯、二氧化氯的分析。
1.氧化还原反应的特点(1)氧化还原反应是基于电子转移的反应,反应机理复杂,常伴随有副反应,且反应条件不同,反应不同。
(2)氧化还原反应常常是分步进行的,需一定的时间才能完成,因而反应速率较慢。
2.条件电势φθ'称为条件电极电势。
条件电极电势反映了离子强度与各种副反应影响的总结果。
一般情况下,溶液中的离子强度的影响远较副反应为小,故一般在溶液中有副反应存在的情况下,忽略离子强度的影响,即γOx=γRed=1,只考虑副反应系数a Ox,a Red。
引入条件电势后,能斯特方程表示成对于有H+及OH一参加的氧化还原电对,因酸度的影响已包括在ψθ'中,因此用能斯特方程计算电对的电势时,H+及OH一便不出现在公式中。
3.氧化还原平衡常数氧化还原进行的程度,由氧化还原平衡常数来衡量。
平衡常数可以用有关电对的标准电势或条件电势求得。
由上式可见,条件平衡常数K'与两电对的条件电势的差值及有关反应中的电子转移数n有关。
对于某一氧化还原反应,n为定值。
两电对的条件电势差值越大,其反应的条件平衡常数K'越大,反应进行得越完全。
若设反应的完全程度99.9 %,则达到化学计量点时,有4.氧化还原反应的速度氧化还原反应是基于电子转移的反应,多数不是基元反应,反应机理比较复杂,反应速度一般较慢。
在滴定反应中,为了加快氧化还原反应的速度,通常采用提高反应物的浓度,升高反应温度,添加适当的催化剂以加快氧化还原反应的速度。
二、氧化还原滴定原理1.氧化还原滴定曲线在氧化还原滴定中,随着滴定剂的不断加入,氧化态或还原态的浓度逐渐变化,其电对的电势也随之不断改变。
以电对的电极电势变化为纵坐标,以滴定剂的加入量为横坐标,绘制曲线即为氧化还原滴定曲线。
第二章酸碱滴定法一、酸碱的定义和共轭酸碱对1.酸碱定义酸碱质子理论认为:给出质子(H+)的物质是酸,接受质子的物质是碱,两者关系如下:2.酸碱反应酸碱反应的实质是质子的转移过程。
3.溶剂的质子自递反应和溶剂的分类(1)溶剂的质子自递反应质子自递反应:溶剂分子间发生的质子传递作用,称为溶剂的质子自递反应。
质子自递常数(Ks ):质子自递反应的平衡常数称为溶剂的质子自递常数。
Ks是质子溶剂的重要特征,其大小反映了质子溶剂产生区分效应范围的宽窄。
(2)溶剂分类酸性溶剂(疏质子溶剂):给出质子的能力强于接受质子的能力,如甲酸、冰醋酸、丙酸和硫酸等。
碱性溶剂(亲质子溶剂):接受质子能力较强的溶剂,如乙二胺、丁胺等。
两性溶剂:给出和接受质子能力相当的溶剂。
如水、乙酸等。
惰性溶剂:既没有给出质子又没有接受质子能力的溶剂,如苯、氯仿等。
4.共轭酸碱对中Ka 和Kb的关系。
Ka ·Kb=Kw多元酸碱中Ka 和Kb的关系(如H3A)K a1·Kb3=Ka2·Kb2=Ka3·Kb1=Kw5.溶剂的拉平效应和区分效应(1)溶剂的拉平效应:溶剂将不同强度的酸拉平到溶剂化质子水平的效应,称为溶剂的拉平效应。
(2)溶剂的区分效应:溶剂能区分酸(碱)强度的效应叫溶剂的区分效应。
溶剂的拉平效应和区分效应与溶剂和溶质的酸碱相对强度等因素有关:较强的碱性溶剂对弱酸具有拉平效应。
较弱碱性的溶剂对弱酸具有区分效应。
较强的酸性溶剂是弱碱的拉平溶剂,是强酸的区分溶剂。
较弱的酸性溶剂对弱酸有拉平效应,对弱碱有区分效应。
惰性溶剂是很好的区分溶剂。
二、溶液中酸碱组分的型体分布酸度:溶液中H+的活度,用pH表示,pH越小,酸度越高。
分析浓度:单位体积溶液中所含某物质的物质的量(mol),包括非解离的和已解离的物质的浓度,用C表示。
(1)一元弱酸(碱)各型体的分布分数:分布分数(δ):溶液中某酸碱组分的平衡浓度占其总浓度的分数。
平衡浓度:达到平衡时,溶液中某一型体的浓度,用[]表示。
浓度为C的一元弱酸HA溶液中存在的型体是HA、A-,则C=[HA]+[A-]。
δHA和δA-一两曲线相交于pH =pK a 点,当pH >pK a 时,A -为主要型体;当pH <pK a时,HA 为主要型体。
分布分数只是pH 和pK a 的函数,与酸及其共轭碱的总浓度C 无关。
(2)多元弱酸(碱)各型体的分布分数:浓度为C 的二元弱酸H 2A 溶液中可能存在的型体有H 2A ,HA -,A 2-,三种型体,则C =[H 2A]+[HA -]+[A 2-]。
在二元酸(H 2A)的分布分数图中,曲线交于pH =pK a1,pH =pK a2点,这两个交点在δH2A=δHA =0.50,δHA =δA2-=0.50处。
当pH <pK a1时,以H 2A 为主;当pK a1<pH <pK 阿时,以HA -为主;当pH >pK a2时,以A 2-为主。
三元酸的分布分数为三、酸碱溶液pH 值计算1.质子条件和质子平衡式物料平衡方程(MBE),电荷平衡方程(CBE)和质子平衡方程(PBE)是酸碱平衡中的基本方程。
最常用的是质子平衡方程。
简单的酸碱反应其电荷平衡方程就是它的质子平衡方程。
书写PBE的要点:(1)在酸碱平衡体系中选取质子参考水准(零水准),一般选取起始酸碱组分和溶剂分子作为参考水准。
(2)以参考水准为基准,在溶液中找出失质子产物,得质子产物及其得失质子数。
(3)根据得失质子平衡原理写出质子平衡式(PBE),得失质子产物浓度乘以得失质子数。
注意方程中不应出现参考水准物质。
2.酸碱溶液中[H+]计算的一般步骤(1)写出溶液的质子平衡方程;(2)代入有关的酸碱平衡常数;(3)整理得[H+]浓度的精确计算式;(4)简化得计算的近似式或最简式。
各种酸碱溶液中[H+]的计算见表2—1所列。
注意事项:(1)忽略水的解离对[H+]的影响,删去计算式中的K项;w(2)当弱酸(碱)解离对总浓度影响较小时,用分析浓度代替平衡浓度;各种酸碱溶液中[H+]的计算表2--1(3)多元酸(碱)溶液中,最重要是一级离解。
3.一元弱酸(碱)溶液的[H+]的计算4.多元弱酸(碱)溶液[H+]的计算多元弱酸(碱)水溶液中,因为Ka1》Ka2》Ka3(Kb1》Kb2》Kb3),所以溶液中H+,OH-主要由第一级离解产生,因此多元弱酸(碱)溶液的酸碱按一元弱酸(碱)来处理。
5.两性物质溶液H+浓度的计算在化学反应中,既能提供质子又能接受质子的物质,称为两性物质。
如HCO3-、H 2PO4-、HPO42-、NH4Ac等。
(3)多元酸(碱)溶液中,最重要是一级离解。
6.缓冲溶液的pH计算公式HA—A-体系7.缓冲指数、缓冲容量及缓冲范围它的物理意义:相关酸碱组分分布线的斜率,缓冲指数具有加合性。
对于HA—A-缓冲体系,总的缓冲指数为当弱酸不太强又不过分弱时,近似式为当Ka =[H+],β有极大值:βmax=0.58CHA。
(2)缓冲溶液的有效缓冲范围:pH=pKA±1。
选择缓冲溶液时,所需控制的pH值应在缓冲溶液的有效范围内,而且pKA应尽量与所需pH接近,这样的缓冲溶液的缓冲能力较强。
(3)缓冲容量α的定义物理意义:某缓冲溶液因外加强酸或强碱的量为△c而发生pH的变化。
β为△pH区间缓冲溶液所具有的平均缓冲指数。
α=αA-=△[A-]=[A-]2一[A-]1一(δ2A-一δ1A)CHA四、酸碱指示剂酸碱指示剂作用原理:酸碱指示剂一般是有机弱酸或有机弱碱。
它们参与溶液中的质子传递反应。
共轭酸与共轭碱因结构不同呈现不同颜色。
当溶液的pH 值改变一定数值时,溶液颜色发生明显变化。
其在水溶液中存在如下平衡:五、酸碱滴定法的基本原理1.滴定曲线以滴定剂的加入量或滴定分数为横坐标,以pH为纵坐标,绘制的曲线叫酸碱滴定曲线。
滴定突跃范围:滴定曲线出现一段几乎平行于纵坐标的线段就是溶液的滴定突跃,把化学计量点前后±0.1%对应的pH范围称为突跃范围。
2.影响滴定突跃范围的因素滴定突跃范围的大小与酸(碱)的强度及溶液的浓度等因素有关。
(1)强酸(碱)滴定强碱(酸):滴定剂与待滴溶液的浓度越大,突跃范围越大。
当滴定剂浓度增加10倍,滴定突跃范围增加2个pH单位,这样可选择的指示剂增多。
(2)强酸(碱)滴定弱碱(酸):滴定剂和弱碱(酸)的浓度越大,突跃范围越大;弱酸的KA 或弱碱的KB越大,突跃范围越大。
强酸滴弱碱,在酸性范围有突跃;强碱滴弱酸,碱性范围有突跃。
当CK1≥10-8时,弱酸(碱)能被准确滴定。
3.多元酸碱的滴定(1)当CKa1≥10-8,CKa2≥10-8,K1/Ka2≥105时,形成两个突跃,准确滴定第一个、第二个化学计量点。
(2)当CKa1≥10-8,CKa2≥10-8,Ka 1/Ka2<10。
时,只形成一个突跃,能准确滴定两级解离出的H+的总量。
(3)当CKa1≥10-8,CKa2≤10-8,形成一个突跃,只能准确滴定第一个化学计量点。
其他多元弱酸(碱)的滴定,依次类推。
4.混合弱酸(碱)的滴定混合弱酸(碱)的滴定与多元弱酸(碱)的滴定类似。
当CKa ≥10-8,C'K'a≥10-8,两种酸都能被准确滴定。
当Ka/Ka'≥105时,有两个突跃,两种酸能被分步准确滴定。
如果两种酸浓度不同,则CKa /CKa'≥105,才能正确判断。
5.酸碱指示剂的选择酸碱指示剂的变色范围必须全部或部分落在计量点附近的pH突跃范围之内。
6.酸碱滴定中CO2的影响酸碱滴定中CO2是造成滴定误差的重要来源,误差的大小与滴定终点时溶液的pH 有关。
假如NaOH溶液在标定前从空气中吸收了少量CO2,那么NaOH溶液中含有少量Na2CO3。
若以KHC8H4O4为基准物,标定NaOH溶液,终点时pH=8~9,酚酞为指示剂,此时CO32-中和为HCO3-。
以此NaOH溶液为滴定剂时,若滴定突跃处于酸性范围,以甲基橙(或甲基红)为指示剂,则CO32-被中和成H2CO3,终点的pH与标定的不同,必造成误差;若滴定突跃在碱性范围,酚酞为指示剂,则CO32-被中和成HCO3-,与标定时一样,对测定结果无大影响。
不含CO32-的标定好准确浓度的NaOH溶液,因保存不当吸收了CO2,以此NaOH溶液,用甲基橙(3.1~4.4)为指示剂,滴定终点时溶液的pH≈4,此时δH2CO3=1,吸收的CO32-。
产生的CO>32-作为碱参加滴定,又转化为H2CO3,这就补偿了吸收CO2造成的损失,不影响标准碱溶液的浓度。
但是酸碱浓度很小时,计量点时pH≈7,必须选甲基红(pH为4.4~6.2)为指示剂。
pH≈7时,δH2CO3=0.1864,δHCO3-=0.8132,CO2的影响较大,最好煮沸溶液驱赶CO2,并配制不含CO2的标准碱溶液。
上述NaOH溶液,若用酚酞(pH8.2~9.8)作指示剂,计量点的pH=9.1,溶液中溶解的CO2>形成的H2C03和标准碱溶液吸收CO2所产生的CO32-,均被滴定成HCO3-。
这时,CO2对滴定的影响不可忽视,并应对标准碱溶液所吸收CO2的物质的量进行校正。
应采用同一指示剂在相同条件下进行标定和测定,可抵消部分CO2的影响。
滴定至终点时,如水中再溶解空气中的CO2会影响某些指示剂终点颜色的稳定性。
若酚酞为指示剂,滴定至计量点附近时溶液呈浅红色,放置0.5~1min后,溶液又变为无色,是由于吸收了空气中CO2并迅速溶解于滴定液中使其pH值降低造成。
当酚酞、溴百里酚蓝和氯酚红等为指示剂,滴定至变色且0.5min内不褪色,可认为达到滴定终点。
7.酸碱滴定的终点误差终点误差:滴定终点与化学计量点不一致而引起的误差。
滴定误差:用指示剂颜色变化确定滴定终点时,因为指示剂的变色点与化学计量点不一致而引起的误差。
(1)强碱滴定强酸式中Kt——滴定反应平衡常数;K i ,Ki+1——多元酸i级,(i+1)级解离常数;△pH——滴定终点与化学计量点时的pH的差值;若[OH-]>[H+],△pH>0,TE>0,结果偏高; [OH-]<[H+],△pH<0,TE <0,结果偏低。
六、水中碱度和酸度(一)碱度1.碱度水中所有能与强酸定量作用的物质的总量,即水中所有能接受质子的物质的总量。
2.水中可能存在的五类碱度组成(1)OH-碱度;(2)OH-和CO32-碱度;(3)CO32-碱度;(4)CO32-和HCO3-碱度;(5)HCO3-碱度。
3.酸碱指示剂滴定碱度(1)连续滴定法以酚酞为指示剂,用HCl标准溶液滴定至终点,溶液颜色由红色变为无色,消耗HCl溶液P mL;接着以甲基橙为指示剂,继续用上述HCl 溶液滴定至终点,溶液颜色由黄色变为桔红色,消耗HCl溶液M mL,计算结果见表2—2。