第四节 中和反应及其应用(导学案)
- 格式:doc
- 大小:66.00 KB
- 文档页数:4

合作探究〖实验〗〖思考〗1.甲中的现象?乙图中的现象?(红色逐渐变淡,直到变成无色)2.甲中的NaOH和HCl发生了反应吗?乙中的NaOH和HCl发生了反应吗?3.乙图中的酚酞起什么作用?4. 稀HCl为什么要逐滴滴加?5.每滴加一滴稀HCl为什么要振荡(或用玻璃棒搅拌)?6.当滴加稀HCl到溶液刚刚由红色变成无色时,说明了什么?7.写出反应的化学方程式。
〖注意〗一,有现象产生,不加指示剂:Cu(OH)2+2HCl = CuCl2 +2H2O(1)NaOH+HCl—(2)AgNO3+HCl—(3)K2CO3+HCl—(4)NaCl+KNO3—10.出由石灰石、碳酸钠和水作原料制备氢氧化钠的各步反应的化学方程式。
11.日常生活中的下列做法,可用物质的化学性质解释的是(B )①用汽油洗掉衣服上的油污②用纯碱除去面团因发酵产生的酸味③用大理石作装饰材料④家族中熬骨汤时,加入少量食醋可以增加汤中的钙质。
A.①②B.②④C.①③④D.②③④向12.40g10%的NaOH溶液中加入60g20%的NaOH溶液,混匀后取一半溶液,滴入2—3滴无色酚酞试液,然后逐渐滴加10%的稀盐酸,直到溶液的红色刚好褪去。
求:(1)混合后,所得NaOH溶液的质量分数。
(16%)(2)中和反应完毕后,所得溶液中溶质的质量分数。
(9.5%)解:混合溶液中NaOH的质量分数为:(40 g×10%+60 g×20%)/(40 g+60 g)×100%=16%13.73克10%的盐酸与80克氢氧化钠溶液恰好完全反应。
求NaOH 溶液中溶质的质量分数和所得溶液中溶质的质量分数。
(10%、7.6%)。


2019-2020年九年级化学《第四节酸碱中和反应》导学案课标要求:学会利用中和反应来改变溶液的酸碱性;了解中和反应在生产、生活中的应用;认识化学对生产和改善人们生活质量的重要性。
内容和学情分析:教材从学生上节课已掌握的中和反应的实质入手,引导学生联想到,中和反应过程中,溶液的酸碱性是如何改变的,中和反应在生产、生活中是如何应用的。
这些问题都是从学生想知道感兴趣的问题,并且学生已知探究的方法,让学生认识比较容易。
教学时,可通过学生身边熟悉的事例,如参观我校附近的污水厂如何处理污水等,让学生感知化学就在我们身边,生活处处有化学。
学习建议:1.在掌握中和反应实质的基础上,了解中和反应在生产、生活中的应用。
2.本节知识与生产、生活息息相关,引导学生把学到的知识应用于生产、生活实际,达到学以致用的目的。
学习目标:1.初步认识中和反应,了解中和反应在生产、生活中的应用。
2.学会用中和反应来改变溶液的酸碱性。
知识点(重点、难点):重点:能通过科学探究积极主动地获得化学知识,解决一些简单的实际问题。
难点:中和反应在生产、生活中的应用。
实验准备:多媒体;试管、试管架、烧杯、玻璃棒、胶头滴管、玻璃片、5%氢氧化钠溶液、5%稀硫酸、酚酞试液、熟石灰教师活动学生活动设计意图一、创设问题情境:出示图片:看到这个图片,你能获得哪些信息?【解释】蚊虫分泌出蚁酸,涂一些碱性物质,可以减轻疼痒。
这也是我们本节课要学习的中和反应在实际中的应用。
【板书】中和反应的应用二、探究学习:【引导归纳】1.用于医疗卫生:观赏图片,发现问题:为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法会消除肿痛?思考解决问题。
阅读课本:P20一P21完成下列问题:1.医疗卫生:人的胃液中含有胃酸(盐酸)运用多媒体创设情境,让学生感受生活中处处有化学,为课题的引入作铺垫。
5.调节溶液的酸碱性:【过渡】下面我们一起探究中和反应过程中溶液pH是如何变化的。
向酸溶液中滴加碱溶液时,溶液的pH逐渐升高,开始反应时pH小于7,恰好完全反应时pH等于7,碱溶液过量时pH大于7。

课题:酸碱中和反应学习目标:1、了解中和反应的定义,与复分解反应的关系;2、理解中和反应的本质与应用;3、中和反应后溶质的确定及如何检验。
导学过程:〖基础知识回顾〗1、中和反应的定义:,生成盐和水的反应一定是中和反应吗?请举例说明。
2、中和反应与复分解反应的关系;中和反应的应用:用熟石灰中和硫酸引起的酸性土壤,用熟石灰中和盐酸泄露。
用氢氧化铝中和胃酸分泌过多。
用盐酸除去水垢(其中一种成分市氢氧化镁)。
〖知识拓展〗酸碱中和反应的实质,观察分析这些微粒个数之间的规律,运用这个规律完成下列方程式:1、盐酸和氢氧化钙2、盐酸和氢氧化铝3、硫酸和氢氧化钙1、硫酸和氢氧化铝〖知识拓展〗知识点一:中和反应后溶质的确定1、盐酸和氢氧化钠反应的实验现象是什么?2、盐酸和氢氧化钠反应后的溶液溶质有哪些?3、盐酸和氢氧化钠反应后如果盐酸过量有哪些方法可以证明过量?4、盐酸和氢氧化钠反应后如果氢氧化钠过量有哪些方法可以证明过量?5、盐酸和氢氧化钠恰好完全反应呢?6、通过加入硝酸银溶液,如果产生白色沉淀,说明盐酸过量?7、酸碱中和反应的温度有何变化?〖自主探究〗〖实验〗将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。
该反应的化学方程式是。
〖查阅资料〗CaCl2溶液显中性。
某化学课堂进行探究实验,将学生分成若干小组开展探究活动。
请你和他们一起完成以下实验探究。
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。
该反应的化学方程式是_____。
【查阅资料】溶液显中性。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?【猜想与假设】针对疑问,甲组同学猜想如下:猜想Ⅰ:只有猜想Ⅰ:有_____;猜想Ⅰ:有和猜想Ⅰ:有和乙组同学对以上猜想提出质疑,认为猜想Ⅰ不合理,其理由是_____。
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案滴加紫色石蕊溶液通入滴加溶液实验操作实验现象__________产生白色沉淀实验结论溶液中含有溶液中含有溶液中含有【得出结论】通过探究,全班同学一致确定猜想Ⅰ是正确的。

中和反应及应用
1.中和反应:酸和碱作用生成盐和水的反应叫中和反应。
强酸和强碱反应,一般没有明显的实验现象(沉淀、气泡、不溶物溶解消失、溶液颜色变化),所以为了观察反应是否发生,需要借助酸碱指示剂。
虽然不能用酚酞溶液鉴别酸性溶液和中性溶液,但借助一种碱溶液,就能将酸性和中性溶液区分出来。
2.中和反应的应用
1)熟石灰改良酸性土壤(在缺少熟石灰的情况下,用生石灰也可以)。
2)熟石灰改良酸性河流(处理硫酸厂的污水:H
2SO
4
+Ca(0H)
2
=CaSO
4
+2H
2
0)。
另外,铁粉、蛋壳(主要成分是碳酸钙)也可改良酸性河流,但它们不属于中和反应。
3)碳酸水可以改良碱性土壤。
4)用含氢氧化铝或氢氧化镁的药物中和过多的胃酸。
其化学方程式为:
AI(OH)
3+3HCI=AICI
3
+3H
2
Mg(OH)
2+2HCI=MgCI
2
+2H
2
当然,也可以用小苏打、墨鱼骨粉(主要成分是碳酸钙)治疗胃酸过多,但它们也不属于中和反应。
5)被蚊虫叮咬时涂含氨水(或者是牙膏、肥皂水)的药物。
3.中和反应同氧化反应、还原反应一样,是特征反应,不属于四大基本反应类型。
4.中和反应是放热的反应。

酸和碱的中和反应导学案
知识目标:
1、认识中和反应的实质、学会利用中和反应来改变溶液的酸碱性。
2、通过对酸和碱反应的探究,初步学会借助指示剂判断物质是否发生化学反应。
能力目标:
进一步揭示宏观与微观的联系,强化学生的学科特征思维
情感目标:
提高学生善于发现生活中的化学问题并对其进行有益思考、设计实验方案、动手操作、分析处理数据、交流合作、反思评价等能力。
一、课前延伸:
1、酸的构成是由和构成的。
酸有共同的化学性
质是决定的。
2、碱的构成是由和构成的。
碱有共同的化学性
质是决定的。
3、你知道如果蒸馒头时,发面时间长了有点酸,你知道该怎么办?,你妈妈是怎样做的?
4、松花蛋味道鲜美,可是有点涩味,你知道该怎样处理么?
从这些处理方法上,你有什么猜测?
二、课内探究
1、自主学习:
看老师的第一次试验,在氢氧化钠溶液中滴加稀盐酸,你看到什么现象?氢氧化钠溶液和稀盐酸是否发生反应了?
2、合作探究:
看老师的第二次试验,思考以下几个问题:(小组内讨论)
(1)该试验中,应先滴加氢氧化钠溶液,后滴加稀盐酸,这个顺序能不能颠倒?
(2)该试验中,酚酞试液起什么作用?
(3)该试验中,加入氢氧化钠溶液,滴加酚酞试液,试液变色,此时溶液呈性,继续加入稀盐酸,直至红色恰好消失,此时溶液呈性,如果继续滴加稀盐酸,此时溶液呈性
写出氢氧化钠与盐酸反应的化学方程式
仿照上面的方程式写出氢氧化钙与盐酸反应的化学方程式
写出氢氧化钠与硫酸反应的化学方程式
三、总结反思:
结合课本知识,想一下在生活中,中和反应有哪些实际应用?。

《酸和碱的中和反应》课时导学案一、教学目标:知识与技能:⑴知道酸和碱之间发生的中和反应,盐的概念。
⑵了解中和反应的实质;会正确书写中和反应的化学方程式;能利用中和反应解决生产生活中的实际问题。
过程与方法:⑴学会借助指示剂判断化学反应发生的探究方法;⑵培养学生用所学知识解决实际问题的能力情感态度与价值观:⑴通过中和反应的实际应用,加深对中和反应的理解,同时体会化学与人类生产、生活、人体健康的密切联系。
⑵体验化学活动充满探究性,培养勇于创新和实践的科学精神。
二、教学重点:知道酸和碱之间发生的中和反应。
三、教学难点:判断是否发生中和反应。
四、教法选择:创景设疑—活动探究—归纳总结—交流讨论―练习实践。
五、课时安排:1课时六、教学准备:1、药品与仪器:NaoH溶液、石灰水;盐酸、稀硫酸、酚酞;坩埚钳、试管、酒精灯、蒸发皿、玻璃棒、火柴等。
相关的cAI。
七、教学过程:项目教师活动学生活动创设意图创景设疑投影:根据所学知识,下列物质中哪些物质之间可以相互反应?Hcl、NaoH、Fe2o3、co2、caco3、Fe写出有关反应的化学方程式。
设疑:酸和碱之间是否会发生化学反应?如果发生化学反应,又会有什么特点?我们通过实验来探究。
描述获取的信息、思考教师的设问。
既复习了物质的类别,又复习了酸的性质以及碱的性质,同时引起一个思维冲突,盐酸和氢氧化钠之间会不会反应?激发了学生主动探究的欲望。
活动探究1、设计探究教师组织学生具体针对这个问题设计、探究。
设计实验1:在盛有氢氧化钠溶液的烧杯中,滴加稀盐酸,观察现象。
①回顾co2与水反应生成碳酸时借助于紫色石蕊来判断,引导学生利用酚酞试剂来判断反应是否进行?设计实验2:在盛有氢氧化钠溶液的烧杯中,滴加2~3滴酚酞试液,观察现象。
---用胶头滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中。
边滴边用玻璃棒搅拌,当烧杯中溶液刚好变成无色时,停止加入盐酸。
在实验过程中,氢氧化钠发生了什么变化?②是盐酸吃掉氢氧化钠还是酸吃掉酚酞?用实验证实你的判断。

第四节酸碱中和反应【学习目标】1.理解中和反应的实质,学会用中和反应来改变溶液的酸碱性;2.知道中和反应在生活中的运用;3.认识盐的组成。
【学习过程】一、导学自习:1.定义:跟作用生成和的反应叫做中和反应。
2.中和反应的实质:。
3.特点:中和反应是(填“吸热”或“放热”)反应;基本类型属于反应。
4.应用(写出化学方程式):(1)、用于医药卫生:氢氧化铝能中和胃酸:(2)、改变土壤的酸碱性:应怎样去改变酸性土壤?(3)、处理工厂的废水:某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?(4)、调节溶液的酸碱性:某溶液的pH=8,为了使其pH降低应该怎么做?(5)、日常生活中:昆虫叮咬的止痛、消肿可用碱性或酸性中和。
5.盐:由和组成的化合物叫做盐。
二、研习展评:学习活动1:通过实验探究盐酸和氢氧化钠能否发生化学反应。
完成P18实验探究7-5 解释与结论:写出上述反应的化学方程式:想一想:其他的酸和碱是否也能发生化学反应呢?完成P19活动天地7-4。
学习活动2:学生观察、讨论认识中和反应的实质,交流回答问题:1.酸与碱反应时,酸溶液中的和碱溶液中的互相结合成了中性的水。
2.写出盐酸和氢氧化钠反应,盐酸与氢氧化钙反应的化学方程式。
想一想:①请同学们观察这两个反应,生成的化合物是不是酸?是不是碱?组成上有什么特点?小结:叫做盐。
②观察这两个反应的化学方程式找寻反应的共同点?小结:叫做中和反应;中和反应的实质:。
学习活动3:阅读P21,交流回答问题:1.用于医药卫生:氢氧化铝能中和胃酸:2.改变土壤的酸碱性:应怎样去改变酸性土壤?3.处理工厂的废水某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?4.调节溶液的酸碱性:某溶液的pH=8,为了使其pH降低应该怎么做?5.日常生活中:昆虫叮咬的止痛、消肿可用碱性或酸性中和。
【课堂练习】1.下列反应,要借助酸碱指示剂,才能判断二者发生反应的是()A. B. C. D.p H 7 T / 时p H 7 T / 时p H 7 T / 时p H 7 T / 时A .大理石和稀盐酸 B .石灰水和稀盐酸C .铁锈和稀硫酸D .镁和稀硫酸2. 有一块农田不长庄稼,经测定是酸性太强,可以适当施入( )A. 石灰石B. 熟石灰C. 草木灰D. 氮肥3.种消化药片的有效成分是氢氧化镁,能减缓因胃酸过多引起的胃痛。

第七单元生活中的酸和碱第四节酸碱中和反应第一课时一、自学目标(只要我努力,我一定能成功!)1、认识中和反应的实质,学会用中和反应来改变溶液的酸碱性;(重点)2、通过对酸和碱反应的探究,提高发现和提出问题的能力;初步学会借助指示剂判断物质是否发生化学反应。
二、知识链接:溶液pH的测定方法:①pH用来表示溶液酸碱性的强弱;②测量方法,用玻璃棒蘸取溶液滴在pH试纸上,与标准比色卡相比,得出溶液的pH。
三、学法指导:中和反应的实质是H++OH-→H2O,判断一个化学反应是不是中和反应的方法:①反应物必须是酸和碱;②生成物必须是盐和水。
自主学习合作探究案(积极参与,认真分析,实现自我!)阅读教材和老师一起通过实验解决以下问题:探究一:盐酸和氢氧化钠发生反应了吗?如何判断?(可由学生设计实验探究方案)实验目的:探究盐酸和氢氧化钠能否发生化学反应实验过程:用滴管向盛有5%的氢氧化钠溶液的试管中加入几滴酚酞试液,然后逐滴加入5%的稀盐酸。
实验现象:随着稀盐酸溶液的滴加,试管内溶液的红色逐渐变浅,当滴加的稀盐酸溶液达到一定量后红色消失,溶液变为无色。
探究二:交流讨论完成下面问题当滴入的盐酸的量较少时,溶液中的有剩余,溶液呈性;当滴入的盐酸与氢氧化钠溶液恰好完全反应时,溶液呈;当滴入的盐酸过量时,有剩余,溶液呈。
反应的化学方程式是。
探究三:绘制pH变化图像1.下图中能正确表示溶液的pH变化的是(横坐标表示加入稀盐酸的质量,纵坐标表示溶液的pH)()2.写出盐酸和氢氧化钠反应,盐酸与氢氧化钙反应的化学方程式。
探究四:在中和反应观察前面反应的化学方程式找寻反应的共同点?小结:叫做中和反应;中和反应的实质:。
当堂达标检测案(试试你的身手,相信你一定行)1.下列反应,属于中和反应的是()A. Zn +2HCl == ZnCl2 + H2B. CuO + 2HCl == CuCl2 + H2OC. Cu(OH)2 + H2SO4 == CuSO4 + 2H2OD . AgNO3 + HCl == AgCl + HNO32.下列反应,要借助酸碱指示剂,才能判断二者发生反应的是()A.大理石和稀盐酸 B.石灰水和稀盐酸 C.铁锈和稀硫酸 D.镁和稀硫酸3.完成下列化学方程式:① Cu(OH)2 + H2SO4 ===② KOH + === K2SO4 +③Mg(OH)2 + H2SO4 ===4.如图所示,某生探究氢氧化钠跟盐酸是否发生反应的装置图。

九年级化学(下册)导学案姓名班级小组小组评价教师评价全反应。
对吗?为什么在操作中必须逐滴滴入稀盐酸,并不断搅拌溶液?2.中和反应的实质是什么?(从微观离子分析)3.有盐和水生的反应一定是中和反应吗?请举例说明。
【合作探究二】【中和反应在实际中的应用】1.改良土壤的酸碱性酸性土壤不利于作物的生长,于是人们将适量的加入土壤以中和酸性。
2.处理工厂废水硫酸厂的污水可以用进行中和处理,化学方程式:。
3.用于药业胃酸过多可以服用某些性物质的药物,以中和过多的胃酸。
人们被蚊虫叮咬后肿起大包,这是因为蚊虫能在人体的皮肤内分泌,如果涂一些碱性物质和蚊虫分泌的蚁酸中和。
胃舒平的主要成分是Al(OH)3,试写出用这种药物治疗胃酸的化学方程式:。
三、自主展示(质疑点评)四、整理学案(归纳小结)五、自主检测(巩固提升):1、某同学不小心被黄蜂蛰了(黄蜂毒液呈碱性),为了减轻疼痛,可以涂抹下列哪种物质()A、浓硫酸B、食醋C、食盐水D、苏打水或肥皂水(呈碱性)2 、下列实际应用中,利用中和反应原理的是()①用生石灰作食品干燥剂②用熟石灰和硫酸铜配制波尔多液③施用熟石灰改良酸性土壤④用氢氧化钠溶液处理泄漏的浓硫酸A.①②B.③④C.①④D.②③3、下列反应中属于中和反应的是()A.CuO+H 2Cu+H2O B.6HCl+Fe2O3==2FeCl3+3H2OC.2H2+O22H2O D.NaOH+HNO3==NaNO3+H2O4.一些国家正在试用碳酸水浇灌某些植物,这样做不能起到的作用是()A.改良碱性土壤B.改良酸性土壤C.促进植物的光合作用D.提高农作物产量5、要借助酸碱指示剂才能判断反应进行情况的是()A、稀硫酸和氧化铁B、稀盐酸和氢氧化铜C 、稀盐酸和氢氧化钠 D、硫酸铜溶液和氢氧化钠溶液6、小烧杯中盛有含石蕊的氢氧化钠溶液,逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是()A 紫色---红色---蓝色 B、蓝色---紫色---红色C 蓝色---红色---紫色D 紫色---蓝色---红色7、下列物质的用途是利用中和反应的是()A 用盐酸除去铁制品表面的铁锈B 用熟石灰改良土壤的酸性C 用一氧化碳冶炼金属D 用干冰进行人工降雨收获感想。
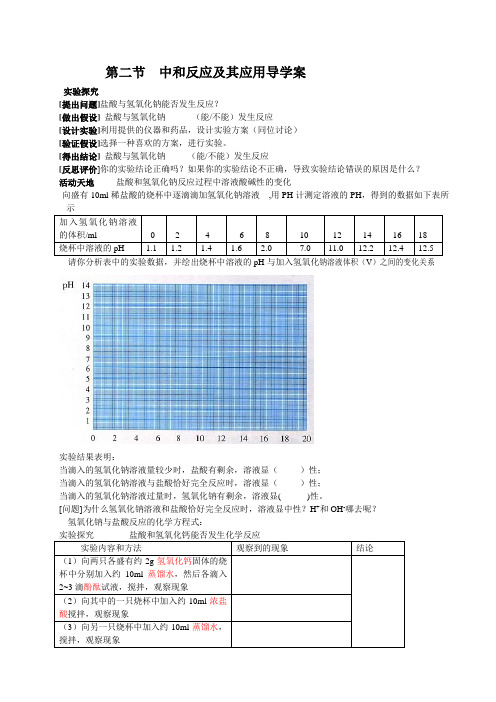
第二节中和反应及其应用导学案实验探究[提出问题]盐酸与氢氧化钠能否发生反应?[做出假设]盐酸与氢氧化钠______(能/不能)发生反应[设计实验]利用提供的仪器和药品,设计实验方案(同位讨论)[验证假设]选择一种喜欢的方案,进行实验。
[得出结论]盐酸与氢氧化钠_____(能/不能)发生反应[反思评价]你的实验结论正确吗?如果你的实验结论不正确,导致实验结论错误的原因是什么?活动天地盐酸和氢氧化钠反应过程中溶液酸碱性的变化向盛有10ml稀盐酸的烧杯中逐滴滴加氢氧化钠溶液,用PH计测定溶液的PH,得到的数据如下表所请你分析表中的实验数据,并绘出烧杯中溶液的pH与加入氢氧化钠溶液体积(V)之间的变化关系实验结果表明:当滴入的氢氧化钠溶液量较少时,盐酸有剩余,溶液显()性;当滴入的氢氧化钠溶液与盐酸恰好完全反应时,溶液显()性;当滴入的氢氧化钠溶液过量时,氢氧化钠有剩余,溶液显( )性。
[问题]为什么氢氧化钠溶液和盐酸恰好完全反应时,溶液显中性?H+和OH-哪去呢?氢氧化钠与盐酸反应的化学方程式:_____________________实验探究盐酸和氢氧化钙能否发生化学反应挑战自我——体验成功一、[生活在线]———生活离不开化学1.某同学不小心被海蛰蛰了(海蛰毒液呈酸性),为了减轻疼痛可以涂抹A.浓硫酸B.食醋(pH=3)C.食盐水(pH=7) D.牙膏或肥皂水(pH=9-10)2.在腌制皮蛋的过程中生成了碱,所以皮蛋吃起来有涩味,要想除去涩味,食用时可加入少量下列物质中的()A. 白糖B、食醋C、酱油D、调料酒二、[实验反思] ———化学离不开实验3.下列变化不能..表明盐酸与氢氧化钠发生了反应的是()A.向氢氧化钠溶液中加入盐酸后,混合溶液的温度升高B.向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大C.向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色褪去D.向氢氧化钠溶液中加入盐酸后,混合溶液的pH<74.在实验室里,欲使碱性溶液变成中性,下列试剂中最好选用哪一种组合()①NaOH溶液②稀盐酸③石灰水④酚酞试液A. ①或③B. 只有②C. 只有①D. ②和④55.在滴有酚酞的NaOH稀溶液中,加入足量盐酸,加酸前后溶液颜色依次为()A.红色、无色B.无色、红色C.红色、蓝色D.蓝色、无色6.某同学为证明氢氧化钠和盐酸能否发生反应,做了如下实验:在试管中加入2~3ml稀盐酸,再滴入1~2滴酚酞溶液。

第七单元 常见的酸和碱第四节 酸碱中和反应学习目标1.学会借助指示剂判断物质是否发生化学反应2.认识中和反应及其实质3. 了解中和反应在生产、生活中的应用学习方法:能通过科学探究积极主动地获得化学知识,解决一些简单的实际问题。
【活动一】氢氧化钠溶液和稀盐酸能发生化学反应吗?根据提供的仪器与药品设计实验设计实验。
【活动二】反应的微观过程描述反应的微观过程。
方案 假设(猜想) 验证方法及操作 可能看到的现象 结论123……【活动三】阅读课本第20页,思考下列问题1、当滴入的盐酸量较少时,溶液中有剩余,溶液显____性,pH 7。
2、当滴入的盐酸与氢氧化钠恰好完全反应时,溶液显刚刚___性,pH 7。
3、当滴入的盐酸过量时,溶液中有剩余,溶液显间接___性,pH 7。
4、写出上述1、2、3中情况时溶液中溶质是:1: 2: 3: 。
【评测练习】1某同学帮助校园绿化工人做花圃土壤分析,结果发现其pH小于7。
为改良土壤应选择的最合适物质是()A.氯化钠B.熟石灰C.氢氧化钠D.硝酸钠2.在实验室里,欲使碱性溶液变成中性,下列试剂中最好选用哪一种组合()①NaOH溶液②稀盐酸③石灰水④酚酞试液A. ①或③B. 只有②C. 只有①D. ②和④3、中和反应在工农业生产和日常生活中有着广泛的用途,下列应用一定与中和反应原理无关的是()A. 施用熟石灰改良酸性土壤B. 服用含有氢氧化铝的药物治疗胃酸过多C. 用熟石灰和硫酸铜配制波尔多液D. 用氢氧化钠溶液洗涤石油产品中的残余硫酸4.经测定某种溶液的pH=4,要使溶液的pH=6,需加入下列哪种溶液()A.pH=2的溶液B. pH=7的溶液C. pH=10的溶液D. pH=4的溶液5.写出下列反应的化学方程式:(1)氢氧化钠和硫酸反应(2)氢氧化钙和硝酸反应6.实验室里有3瓶标签模糊不清的无色溶液:稀硫酸、氯化钠溶液、氢氧化钠溶液。
请你只用酚酞指示剂和适当的仪器设计一个简单的实验,将3种溶液区分开来,并写出有关的实验现象和结论。

九年级化学第二单元第四节酸碱中和反应导学案一、【目标定向】1.认识酸碱指示剂在酸碱溶液中的颜色变化,会用酸碱指示剂检验溶液的酸碱性,能够利用酸碱指示剂识别酸和碱。
2.知道溶液的酸碱性与pH的关系,并学会用pH试纸检验溶液的酸碱性强弱。
3.会判断常见的酸、碱、盐三类化合物。
4.从H+和OH—的角度识别溶液呈酸碱性的原因,建立宏观与微观的思维联系的方式。
了解酸碱性对生命活动和作物生长的影响。
5.认识中和反应的实质,学会利用中和反应改变溶液的酸碱性,了解中和反应在生活中的应用。
二、【自主预习】一、酸碱指示剂1.定义:与作用而显示的物质,叫酸碱指示剂。
2.常见的酸碱指示剂有色的和色的。
3、紫色石蕊试液遇酸_____,遇碱______,遇到中性物质______无色酚酞试液遇到酸________,遇到碱____________,遇到中性物质__________。
4、为了方便操作我们还把石蕊试液制成试纸,常用___色的石蕊试纸检测酸,用____色的石蕊试纸检测_____。
在使用试纸时,我们用__________蘸取少量待测液,滴在试纸上,酸溶液能使蓝色石蕊试纸变____,碱溶液能使红色石蕊试纸变_____。
二、溶液酸碱性的强弱程度1.溶液的酸碱性用来检验,溶液的酸碱度常用来表示。
2.pH范围通常在之间,pH 7,溶液显中性;pH 7,溶液显碱性,pH 越小,碱性;pH 7,溶液显酸性,pH 越小,酸性。
3.pH的测定方法:。
用pH试纸测得pH精确到。
4.氢离子浓度越高,酸性越,酸溶液稀释时,溶液的pH变;氢氧根离子浓度越高,碱性越,碱溶液稀释时,溶液的pH变。
三、中和反应1.定义:的反应,叫中和反应,它属于反应。
2.实质:和反应生成。
3.应用(1)改变,如:酸性土壤通常加入改良。
(2)处理,如:用熟石灰中和硫酸厂的污水中含有的硫酸杂质,写出反应的化学方程式:(3)应用于,如:用氢氧化铝中和胃酸过多,写出反应的化学方程式:。

第四节酸碱中和反响一、导学指导【学习目标】1.能设计实验证明酸与碱之间发生了化学反响;2.知道什么叫做中和反响,了解中和反响的特点,认识中和反响的微观实质;3.了解中和反响在工农业生产、生活、生理及实验室等各方面的应用,并能写出常见的化学方程式;4.知道盐的定义,能识别酸碱盐;5.知道复分解反响的定义,知道中和反响属于复分解反响。
【学习重难点】1.知道什么叫做中和反响,了解中和反响的特点,认识中和反响的微观实质;。
2.了解中和反响在工农业生产、生活、生理及实验室等各方面的应用,并能写出常见的化学方程式。
二、课堂建议【学习活动】活动一:探究中和反响如果把一种酸溶液参加一种碱溶液中,会反响吗?完成如图实验:现象:。
学实验探究的一般步骤:1.提出问题:?2.假设与猜测:。
3.设计实验方案:4.进行实验探究:1.定义:与作用生成的反响叫做中和反响。
即: + = +活动二:分析中和反响的微观实质2.化学反响方程式:HCl + NaOH = NaCl + H2OH+、Cl- + Na+、OH- = Cl-、Na+ + H2O〔分子〕3.微观实质:。
4. 盐 = + 。
5.特点:中和反响是反响。
活动三:中和反响在日常生活、生产中的应用看教材 P21完成化学方程式(1)~(4)〔1〕农业生产中:酸性〔含硝酸〕土壤可以用熟石灰[Ca(OH) 2]来中和改良。
〔2〕生理上:胃酸(含盐酸)过多,可以用氢氧化铝[Al(OH) 3]等来中和治疗。
〔3〕实验室里:用酸来清洗残留在试管等容器内壁的难溶碱。
[稀H2SO4洗Cu(OH)2;稀盐酸洗Fe(OH)3等]〔4〕工业生产中处理工厂的一些废水〔含H2SO4〕可用氨水〔NH3·H2O〕来中和。
〔5〕日常生活中:昆虫叮咬的止痛、消肿可用碱性或酸性中和。
〔6〕调节溶液酸碱性在学实验室里,经常要把溶液的pH控制在一定范围内,如果溶液的酸性或碱性太强,就可以用适当的碱或酸调节溶液的pH。

第七单元第四节中和反应及其应用【教学目标】知识与技能: 1.认识中和反应的实质;2.学会利用中和反应来改变溶液的酸碱性||。
过程与方法:通过对酸和碱反应的探究||,提高发现和提出问题的能力||,初步学会借助指示剂判断物质是否发生化学反应||。
情感态度与价值观:1.了解中和反应在生产、生活中的应用;2.认识化学对生产和改善人们生活质量的重要性||。
【重点、难点】中和反应的实质||,物质是否发生化学反应的判断方法||。
【教学过程】一、创设情境||,问题导入1、小明的妈妈不小心把面团发酸了||,你能帮帮她吗?做法:2、为什么加碱可以去掉酸味?思考||,猜测:3、其他酸和碱是否也能发生化学反应?猜测:(能或不能)二、合作交流、探究新知1、探究:盐酸与氢氧化钠能否发生化学反应(1)教师演示:①倒5%的盐酸②滴加5%的氢氧化钠溶液③现象:(2)猜想:①②(3)运用所学设计实验探究||,通过明显的实验现象以验证反应是否发生:(4)的方案简便易行(5)学生演示(6)结论:(7)反思:第1页/共4页2、认识中和反应:(1)、微观解释:盐酸中的和氢氧化钠溶液中的结合成了||,导致溶液原有的酸碱性“中和”的结果||。
(2)、写出反应化学方程式:(3)、认识盐的结构:盐==(4)、归纳中和反应概念:(5)、理解中和反应实质:(配平依据):3、反应过程中的酸碱性变化(活动天地)(1)学生解释:数据意义(18、7)(2)下列图像描绘正确的是:(向一定量的氢氧化钠溶液中逐渐滴加盐酸溶液)()(3)分析曲线||,得出结论:①当滴入的盐酸量较少时||,耗尽||,有剩余||,溶液呈性||,PH 7||,此时溶液中的溶质是||。
②当滴入的盐酸与氢氧化钠溶液恰好完全反应时||,溶液呈性||,PH 7||,此时溶液中的溶质是||。
③当滴入的盐酸过量时||,耗尽||,有剩余||,溶液呈性||,PH 7||,此时溶液中的溶质是||。
(4)哪一点的信息最为关键(||,)||,原因是PH= 时||,溶液呈性||,即没有和||。
第四节中和反应及其应用
教学目标:1.知道中和反应,了解中和反应的实质,
2.知道中和反应在生活中的应用
教学重点:中和反应
教学难点:探究中和反应的发生
教学过程:
(一)知识的复习与准备
1、用酸碱指示剂可以识别酸碱性物质吗?能否知道酸碱性强弱?
用什么可以测出溶液的酸碱性强弱?
2、pH与溶液的酸碱性有什么关系?
3、区分稀盐酸、NaOH溶液你有哪些方法?加上水呢?
(二)新授
1、探究实验:氢氧化钠溶液和稀盐酸发生化学反应吗
(分组设计并完成实验)
实验证明,盐酸和氢氧化钠能发生反应,反应的化学方程式为_________________ 反应的实质是:______________________。
2、中和反应:
(1)书写中和反应的化学方程式:
硫酸+氢氧化钠:
盐酸+氢氧化铜:
硫酸+氢氧化钡:
盐酸+氢氧化钡:
硫酸+氢氧化铜
(2)判断下列反应是否属于中和反应?
A. 2NaOH+CO2=Na2CO3+H2O
B. CaO+2HCl=CaCl2+H2O
C. Mg(OH)2+H2SO4= MgSO4+ 2H2O
P
质(3)总结:
中和反应的定义
中和反应的实质:
基本反应类型:
3、中和反应过程中溶液PH 的变化:
• 1、M 点时,滴入盐酸量较少时,溶液中_______有剩余,溶液呈__性,PH__7; • 2、A 点时,滴入的盐酸量恰好与氢氧化钠完全反应时,溶液呈__性,PH___7; • 3、P 点时,滴入盐酸过量时,溶液中____有剩余,溶液呈____性,PH___7。
4、中和反应的应用:
(1)通常人们会向酸性土壤中撒 来把土壤的的pH 控制在最适宜庄稼生长的范围之内;
(2)若污水中的酸超标(主要含H 2SO 4),人们可以加入熟石灰(Ca (OH )2) 来进行中和处理,其反应的化学方程式为: ;
(3)人的胃酸(HCl )分泌过多会感到不适,可服碱性药物进行中和,如服用含Al (OH )3药物,反应的化学方程式为 ;
(4)在科学实验里,如果溶液的酸性或碱性太强,就可以用适当的碱或酸调节溶液的pH 。
(三)学以致用:今天的废液应怎样处理?
(四)你的收获:
课堂检测:
1. 向盐酸溶液中逐滴加入氢氧化钠溶液,所得溶液的PH 与加入氢氧化钠溶液的质量关系曲线图合理的是( )
A B C D
2.判断下列反应属于中和反应的是( )
A 、CaCO 3 +2HCl===CaCl 2 +H 2O+CO 2↑
B 、CO 2+H 2O===H 2CO 3
C 、CO 2+Ca(OH)2=== CaCO 3↓+ H 2O
D 、2HCl+Ca(OH)2=== CaCl 2 +2H 2O
3. 下列物质按酸碱盐的顺序排列的是( )
A 、HNO 3、Na 2CO 3、BaSO 4
B 、Na 2SO 4、KOH 、NaCl
C 、H 2CO 3、Ca(OH)2、MgO
D 、H 2SO 4、NaOH 、CaCl 2
4、向滴有酚酞的氢氧化钠的溶液中,逐滴滴入稀盐酸至过量,下面叙述中正确的是( )
A.溶液由红色变为无色,PH 逐渐增大
B. 溶液由无色变为红色,PH 逐渐减小
P
C. 溶液由红色变为无色,PH 逐渐减小
D. 溶液不变色,PH 逐渐增大
5、小玲在晚会上表演如下魔术:用毛笔蘸取一种无色液体A 在一张白纸上写出“化学”两字,然后再喷上一种无色液体B ,白纸上的字马上变为红色;再喷上一种无色液体C 时,红字消失了,则无色液体A 、B 、C 可能是( )
A. 酚酞试液 硫酸 氢氧化钠
B. 氢氧化钠 水 酚酞试液
C. 石蕊试液 氢氧化钠 稀盐酸
D. 氢氧化钠 酚酞试液 稀盐酸
6、强酸性土壤不适合植物生长,可用来中和土壤酸性的是( )
A.食盐
B.氢氧化钠
C.熟石灰
D.盐酸
7、借助下列物质和用品,仍不能证明稀盐酸和氢氧化钙溶液是否发生化学反应的是( )
A 、紫色石蕊试液
B 、无色酚酞试液
C 、pH 试纸
D 、氯化钙溶液
8、下列物质的用途由化学性质决定的是( )
A 、用氢氧化钙降低土壤酸性
B 、用铁铸锅
C 、用氢气填充气球
D 、用石墨作电极
9、盐酸中滴入酚酞试液后 仍为无色,要使溶液呈红色可加入( )
A 、硫酸
B 、水
C 、食盐
D 、氢氧化钠
10、下列有关盐酸与氢氧化钠溶液中有关粒子之间的反应,说法错误的是( )
A 、盐酸溶液中含有氢离子和氯离子
B 、氢氧化钠溶液中含有钠离子和氢氧根离子
C 、两种溶液混合时,氢离子和氢氧根离子结合生成了水分子
D 、两种溶液混合时,钠离子与氯离子结合成了氯化钠分子
11、用稀的碱性溶液或清水浸泡,可使残留在蔬菜上的农药降低毒性。
如用碱性溶液浸泡蔬菜,可在水中加入适量的 ( )
A.白酒
B.纯碱
C.白糖
D.食醋
12、有A 、B 、C 三种溶液,A 能使紫色石蕊试液变红,B 能使无色酚酞试液变红,C 遇紫色石蕊试液和无色酚酞试液均无变化,则三种溶液的pH 由大到小的顺序是( )
A.A >C >B
B.C >B >A
C.B >A >C
D.B >C >A
13.将一定质量分数的NaOH 溶液加水稀释,下列图象能正确表示pH 变化的是( )
14、右图为喷墨打印机工作原理示意图。
溶解在打印墨水 (pH :
7.5~9.0)中的染料,从喷嘴喷到打印纸(pH :
4.5~6.5)上,变为不溶于水的固体。
下列说法正确的是 ( )
A.打印墨水偏酸性
B.打印墨水显中性
C.打印纸偏酸性
D.打印纸偏碱性
墨水
pH 7.5~9.0 打印纸 pH 4.5~6.5
15.在进食过程中与进食后定时测定唾液的pH,发现进食开始至10 min时,唾液的酸性逐渐增强,10~40 min时酸性逐渐减弱。
以下图象符合事实的是 ( )
16、写出下列反应的化学方程式:
(1)用盐酸清洗热水瓶的水垢(主要成分是Mg(OH)2和CaCO3)
_________________________________ _____________________________________
(2)用石灰水处理化工厂排放的废硫酸污水_____________________________________
(3)用胃舒平(含氢氧化铝)治疗胃酸过多_______________________________________ 17、某同学发现某一农田的庄稼生长的不好,他测定土壤的pH为5.7,得知土壤呈______性。
于是他建议施用农家肥料草木灰来改良土壤,由此可知,草木灰属于_______性物质。
(填“酸”或“碱”)、
18、用滴管向盛有5%的盐酸的试管中滴加5%的氢氧化钠溶液,观察现象。
【提出问题】你认为盐酸和氢氧化钠溶液发生化学反应吗?
【猜想】盐酸和氢氧化钠能发生化学反应
【搜集证据】小明和小亮分别用酸碱指示剂和pH试纸设计了两个实验方案。
方案1:小明取少量NaOH溶液放入试管中,用胶头滴管滴入几滴酚酞试液,此时溶液变为_________色。
然后逐滴往试管中滴加稀盐酸并振荡,看到的现象是试液由_____色逐渐变为_____色。
方案2:小亮先用玻璃棒蘸取NaOH溶液,滴在pH试纸上,发现NaOH溶液的pH_______7,然后把少量NaOH溶液放入试管中逐滴加入一定量的盐酸,振荡后,再取混合后的溶液滴到pH试纸上,发现混合液的pH______________。
【实验结论】小明认为盐酸和氢氧化钠________反应,小亮认为盐酸和氢氧化钠_______反应。
(填“能”或“不能”)
【交流与反思】小明和小亮把自己的实验方案和结果与同学们进行了交流,同学们认为
________的方案更简便易行。