盐卤厂的工艺流程
- 格式:docx
- 大小:37.17 KB
- 文档页数:3

山东省2023届高考化学二轮复习工艺流程题专项练3解析版一、选择题 每小题只有一个选项符合题意,每小题3分,共24分。
1.以下是侯氏制碱法的简单流程,下列说法正确的是( )A .氨和二氧化碳的通入顺序应该调换B .操作X 为过滤,为加快过滤速率,过滤时用玻璃棒搅拌C .侯氏制碱法的主要原理是相同条件下Na 2CO 3易溶于水,NaHCO 3难溶于水D .向溶液B 中通入氨并加入氯化钠粉末可得到副产品NH 4Cl ,通入氨的目的是增大NH +4 的浓度,有利于析出NH 4Cl 并提高纯度【答案】 D【解析】A 项,氨和二氧化碳的通入顺序不能颠倒,因为氨极易溶于水,二氧化碳的溶解度较小,先通入氨可以更多地吸收二氧化碳,反应生成碳酸氢钠,A 错误;B 项,过滤时不能用玻璃棒搅拌,避免弄破滤纸,B 错误;C 项,碳酸钠和碳酸氢钠都易溶于水,但相同温度下碳酸氢钠的溶解度小于碳酸钠,C 错误;D 项,氨溶于水后与水反应生成一水合氨,电离出铵根离子,增大铵根离子浓度,有利于析出氯化铵并提高纯度,D 正确。
2.某工厂用提取粗盐后的盐卤(主要成分为MgCl 2)制备金属镁,其工艺流程如下。
下列说法中错误的是( )A.步骤Ⅰ发生的反应为非氧化还原反应B.若在实验室进行操作①,只需要漏斗和烧杯两种玻璃仪器C.操作②是蒸发浓缩、冷却结晶D.在整个制备过程中,未发生置换反应【答案】B【解析】步骤Ⅰ发生反应MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2,该反应是非氧化还原反应,A项正确;操作①是过滤操作,用到烧杯、漏斗、玻璃棒三种玻璃仪器,B项错误;操作②是由MgCl2溶液制得MgCl2·6H2O,操作是蒸发浓缩、冷却结晶,C项正确。
3.(2021·山东烟台二模)工业上利用锌焙砂(主要含ZnO、ZnFe2O4还含有少量FeO、CuO等)湿法制取金属锌的流程如图所示。
下列说法错误的是()A.ZnFe2O4与硫酸反应的离子方程式:ZnFe2O4+8H+===Zn2++2Fe3++4H2O B.加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+C.加过量的ZnS可除去溶液中的Cu2+是利用了K sp(ZnS)>K sp(CuS)D.为增大反应速率,“净化Ⅰ”和“净化Ⅰ”均应在较高的温度下进行【答案】D【解析】流程分析如下:ZnFe2O4与硫酸反应生成Zn2+、Fe3+、H2O,离子方程式为ZnFe2O4+8H+===Zn2++2Fe3++4H2O,A正确;加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+[生成Fe(OH)3沉淀],B正确;加过量ZnS可除去溶液中的Cu2+,是利用了K sp(ZnS)>K sp(CuS),C正确;“净化Ⅰ”中的H2O2在温度较高时会分解,该反应需要控制温度不能太高,D错误。


2023北京初三一模化学汇编盐的性质6.(2023·北京大兴·统考一模)某工厂用提取粗盐后的盐卤(主要成分为MgCl 2)制备金属镁,其工艺流程 如下:(1)盐卤属于______(填“纯净物”或“混合物”)。
(2)① 中发生的是复分解反应,反应的生成物为Mg (OH )2、______。
(3)① 中镁元素的化合价______(填“升高”“降低”或“不变”)。
7.(2023·北京石景山·统考一模)卤水净化是氯化钠生产的重要工序之一,烧碱一纯碱法净化工艺中产生的盐泥可用于制备氯化钙,实现变废为宝、资源再利用,其主要工艺流程如下图。
已知:①盐泥的主要成分为CaCO 3和少量的Mg(OH)2、Fe(OH)3等不溶性杂质。
①Mg(OH)2、Fe(OH)3能与盐酸发生中和反应。
①MgCl 2、FeCl 3能与碱发生复分解反应。
(1)纯碱的化学式为_____________。
(2)上述过程中属于分离提纯的是______、结晶、干燥。
(3)Mg(OH)2与盐酸反应的化学方程式为____________。
(4)调节pH 至8~9、pH 至3~4,加入的物质分别是______,______ (填序号)。
A .Ca(OH)2溶液 B .蒸馏水 C . 盐酸 D .硫酸8.(2023·北京通州·统考一模)氯化钙常用作干燥剂,以石灰石(主要成分CaCO 3,含少量MgCO 3及不溶于水和盐酸的杂质)制备氯化钙的主要过程如下:(1)石灰石的主要成分与稀盐酸反应的化学方程式为_______。
(2)溶液A 与石灰水反应的其中一个化学方程式为()()2222Ca OH MgCl Mg OH CaCl ↓+=+,该反应的基本反应类型为_______。
资料:H WO不易溶于水(1)吸收器中NaOH溶液要从顶部进入喷洒而下,目的是___________。
(1)化盐桶中,加快水的循环速度的目的是______。

制盐工艺的四大流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classicarticles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!制盐工艺的四大流程1. 采卤从盐矿或盐湖中提取含盐溶液。
盐矿采卤:通过钻孔或开采盐矿,将盐岩溶解于水中,形成盐卤。

一、选择题(每小题4分,共48分)1.某课外小组将灼烧海带产生的灰烬浸泡后过滤,得到澄清的滤液。
他们设计了如下几个方案,你认为能证明海带的灰烬中含有碘元素的是(D)A.取适量滤液,蒸干,观察是否有紫色固体生成B.取适量滤液,加入苯,振荡,静置,苯层无色,证明不含碘元素C.取适量滤液,向其中加入淀粉溶液,无明显现象,证明不含碘元素D.取适量滤液,加入酸化的H2O2,再加入淀粉溶液,呈蓝色,证明含有碘元素解析:海带的灰烬中含有的碘元素,是以I-形式存在的,不是以单质形式存在,所以A、B、C均不正确。
D中发生了氧化还原反应:H2O2+2I-+2H+===I2+2H2O,产生了I2,使淀粉溶液呈蓝色。
2.从淡化海水中提取溴的流程如下图所示,下列有关说法错误的是(D)A .X 为SO 2气体,也可将SO 2换成Na 2SO 3B .设备Y 为蒸馏塔C .在提取溴的过程中一定有Br -被氧化D .工业上,每获得1 mol Br 2,需要消耗Cl 2的体积最多为22.4 L(标准状况)解析:根据反应Cl 2+2Br -===Br 2+2Cl -知在工业制Br 2过程中发生了两次氧化,所以工业上获得1 mol Br 2,需要消耗Cl 2的体积最少为44.8 L(标准状况),D 项错误。
3.下列说法正确的是( B )A .海洋约占地球表面积的71%,所以地球上不缺水,人类可以随意使用水资源,不必节约B .海水淡化的主要方法有蒸馏法、电渗析法和离子交换法C .海水淡化的各种方法中,蒸馏法的成本比较低D .以上说法都正确解析:地球表面咸水多,淡水少,许多国家面临着淡水资源的危机,故不可以随意浪费水资源,A 错误;海水淡化中蒸馏法的成本较高,C 错误。
4.下列有关化学方程式与工业生产实际不相符的是( C )A .海水提溴时用SO 2吸收Br 2蒸气:SO 2+Br 2+2H 2O===H 2SO 4+2HBrB .将煤气化为可燃性气体:C(s)+H 2O(g)=====高温CO(g)+H 2(g)C .用电解法从海水中提取镁:2MgO(熔融)=====通电2Mg +O 2↑D .燃煤时加入CaCO 3脱硫:2CaCO 3+2SO 2+O 2=====△2CaSO 4+2CO 2解析:二氧化硫可以和溴单质发生氧化还原反应生成氢溴酸和硫酸,即SO 2+Br 2+2H 2O===H 2SO 4+2HBr ,A 正确;煤的气化过程中,碳在高温下和水蒸气发生成反应生成氢气和一氧化碳,即C(s)+H 2O(g)=====高温CO(g)+H 2(g),B 正确;用电解法从海水中提取镁:MgCl 2(熔融)=====通电Mg +Cl 2↑,C 错误;燃煤时加入CaCO 3脱硫的化学方程式为2CaCO 3+2SO 2+O 2=====△2CaSO 4+2CO 2,D 正确。


工艺流程图选择题1.(广东试验中学2024届高三阶段测试)钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。
工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:已知:钒有多种价态,其中+5价最稳定。
钒在溶液中主要以和的形式存在,且存在平衡VO2++H2O VO3-+2H+。
下列说法正确的是A.工业生产中,碱浸步骤可选用较为廉价的氨水B.可以推想VO2Cl溶解度大于NH4VO3C.焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全D.将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中肯定不含铁元素【答案】B【解析】赤泥进行碱浸,氧化铝溶解形成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀。
滤渣1系列操作得到V2O5,可知滤渣1中含有Fe2O3、V2O5及少量稀土金属氧化物,进行还原、磁选,磁性产品中含有Fe等,非磁性产品含有V元素,在空气中焙烧后用盐酸溶解,钒在溶液中主要以VO2+和VO3﹣的形式存在,再加入氯化铵转化为NH4VO3,焙烧得到V2O5,由溶液中存在平衡VO2++H2O VO3-+2H+,盐酸过量会抑制的生成NH4VO3,盐酸溶解时不宜过量。
氧化铝不溶于弱碱,氨水不能溶解氧化铝,故A错误;B.用盐酸溶液后的溶液中含有VO2+和VO3﹣、Cl﹣,加入氯化铵生成NH4VO3沉淀,反应向生成更难溶的物质进行,可以推想VO2Cl溶解度大于NH4VO3,故B正确;C.溶液中存在平衡VO2++H2O VO3-+2H+,盐酸过量平衡逆向移动,会抑制的生成NH4VO3,所以不能加入过量的盐酸,故C错误;D.磁性产品中有铁的单质存在,若加入的硝酸不足,Fe元素被硝酸氧化可能生成亚铁离子,亚铁离子遇KSCN溶液无明显现象,故D错误;故选B。
2.(湖南省衡阳市第八中学2024届高三月考)用适当浓度的盐酸、NaCl溶液、氨水、铁粉和葡萄糖溶液可依据如图方法从某含有Cu2+、Ag+的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。
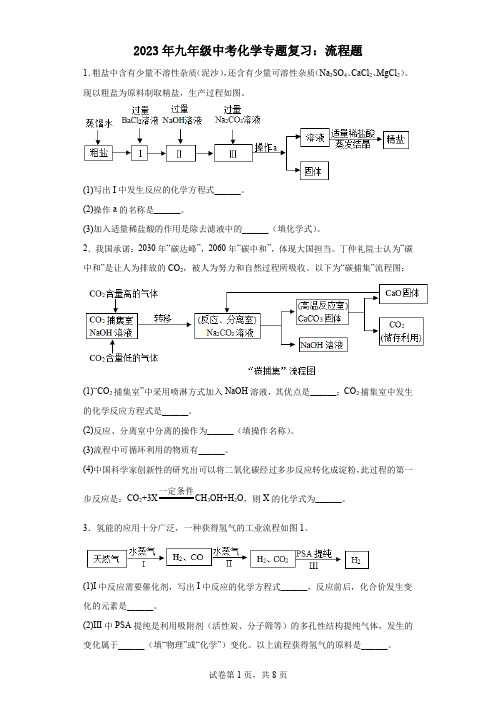
2023年九年级中考化学专题复习:流程题1.粗盐中含有少量不溶性杂质(泥沙),还含有少量可溶性杂质(Na2SO4、CaCl2、MgCl2)。
(3)1mol 氢分子中约含有______个氢原子。
(4)氢气还原氧化铜的化学方程式是______。
4.以电石渣(主要成分为Ca (OH )2,含少量MgO 等杂质)为原料制备高纯活性纳米CaCO 3的流程如下:【资料】①氨水的pH 约为11.7,氢氧化镁完全沉淀的pH 约为10.87 ①232234CaCl +2NH +H O+CO =CaCO 2NH Cl ↓+(1)加入NH 4Cl 将溶液酸化,说明NH 4C1溶液的pH______7(填“>”、“=”或“<”);酸化浸取时Ca (OH )2和NH 4Cl 反应生成氯化钙、氨气和水,反应的化学方程式为:______。
(2)向滤液1中通入NH 3调节溶液pH ,主要目的是: ①使滤液2能吸收更多CO 2; ①______。
(3)流程中可循环利用的物质是NH 3和______。
5.5G 时代已经来临,高纯度单质硅是制作芯片的重要材料。
(1)硅元素在地壳中含量(质量分数)位居第______位(填数字)。
(2)硅元素在周期表中信息如图所示,据此可知硅原子的核外电子数为______,相对原子质量为______。
工业上利用石英砂(主要成分是二氧化硅)制备高纯硅和高纯二氧化硅的主要工艺流程如图所示。
(3)石英砂中主要成分二氧化硅的化学式为______。
(4)反应①中体现了焦炭的______性。
(5)用于制造光导纤维的高纯二氧化硅,可利用反应①制备,同时生成一种气体单质,该溶液,小曹同学设计的实验流程如下:(1)操作b的名称是_______。
(2)操作a中玻璃棒的作用是_______。
(3)步骤①中过量NaOH溶液的作用是_______。
(4)能否将步骤①和步骤①的顺序颠倒,请简述理由:_______。

(化学)化学科普阅读题练习题含答案及解析一、中考化学科普阅读题1.宁厂古镇位于重庆巫溪县附近,是中国早期制盐地之一,距今约5000年之久。
其主要的工艺流程如下:先将盐卤(亦称卤水或卤汁)引入深达数米的贮卤池沉淀杂质,再经笕管导入纵向排列的数口铁锅中开始熬。
卤水先经大火煎煮,迅速蒸发水分,然后利用豆汁或蛋清、猪血等吸附硫酸钙等杂质,再用竹编的筛子舀起,称为“提浆”。
提浆之后的锅内盐卤“清澈见底”,之后用小火慢慢熬煮,适时下母子渣盐(盐种),促使卤水结晶成盐粒。
已经结晶的盐粒还需要经过淋花水的工序。
花水是一种卤汁,将卤汁一遍遍淋在刚刚结晶的盐粒上,洗去盐粒表面残留的杂质,增加盐粒的亮泽度。
之后滤去残留的水分,再转至烘干炕摊开烘干,最后打包、计重、入库房。
(1)“提浆”和实验室“过滤”一样,都是为了除去溶液中不溶性杂质,在实验室的过滤操作中必需要用到的玻璃仪器有烧杯、玻璃棒和____。
(2)熬盐和实验室的____原理相同。
(3)竹编的筛子相当于实验室的过滤操作中所用到的____。
(4)花水是氯化钠的____(填“饱和”或“不饱和”)溶液。
(5)氯化钠是重要的化工原料。
工业上通过电解饱和食盐水来大量制取烧碱, 同时得到二种副产物氢气和氯气,反应的化学方程式为____。
【答案】漏斗 蒸发 滤纸 饱和 2222NaCl 2H O2NaOH Cl H ++↑+↑通电 【解析】【分析】【详解】(1)过滤过程中用到玻璃仪器有烧杯玻璃棒漏斗,故填:漏斗;(2)熬盐和实验室蒸发的原理相同,故填:蒸发;(3)竹编的筛子起到过滤作用,相当于滤纸,故填:滤纸;(4)花水是一种卤汁,洗去盐粒表面残留的杂质,只去除杂质不溶解氯化钠,是氯化钠的饱和溶液,故填:饱和;(5)电解饱和食盐水制取烧碱, 同时得到副产物氢气和氯气,化学方程式为: 2222NaCl 2H O2NaOH Cl H ++↑+↑通电【点睛】 该题考察过滤操作的原理,及注意事项2.阅读下列科普短文。

化学工艺流程类选择题【易错分析】把化学工艺流程题改造成选择题是近几年高考试题出现大题小考的命题倾向,解答时,要明白命题人的命题意图,明确将原料转化为产品的生产原理、除杂并分离提纯产品的方法、提高产量和产率的措施、减少污染注意环保的“绿色化学”思想、原料的来源丰富和经济成本等。
解答时,要注意分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么,B.发生了什么反应,C.该反应造成了什么后果,对制造产品有什么作用;抓住一个关键点:一切反应或操作都是为了获得产品;从选项中获取信息,帮助解题,了解流程后着手答题;对反应条件的分析可从以下几个方面着手:对反应速率有何影响、对平衡转化率有何影响、对综合生产效益有何影响(如可以从原料成本,原料来源是否广泛、是否可再生,能源成本,对设备的要求,环境保护等方面考虑)。
【错题纠正】例题1、某工厂用提取粗盐后的盐卤(主要成分为MgCl2) 制备金属镁,其工艺流程如下,下列说法中,错误的是A.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器B.操作②是蒸发浓缩、降温结晶过滤、洗涤等步骤C.操作③通入HCl气流是为了抑制MgCl2的水解D.在整个制备过程中,未发生置换反应【解析】A项,盐卤中加入足量的石灰浆,盐卤中的Mg2+完全转化为Mg(OH)2沉淀,用过滤法进行分离,需要的主要玻璃仪器有:烧杯、漏斗、玻璃棒,错误;B项,从MgCl2溶液中获得MgCl2·6H2O的操作是:蒸发浓缩、降温结晶、过滤、洗涤,正确;C项,若直接加热MgCl2·6H2O,MgCl2水解生成Mg(OH)2和HCl,加热由于HCl的挥发促进MgCl2的水解,最终不能获得无水MgCl2,为了抑制MgCl2的水解在HCl气流中加热,正确;D项,盐卤中加入足量石灰浆、Mg(OH)2与盐酸的反应都为复分解反应,MgCl2·6H2O→MgCl2以及MgCl2→Mg为分解反应,整个制备过程未发生置换反应,正确。

(化学)初中化学化学科普阅读题解题技巧讲解及练习题(含答案)含解析一、中考化学科普阅读题1.宁厂古镇位于重庆巫溪县附近,是中国早期制盐地之一,距今约5000年之久。
其主要的工艺流程如下:先将盐卤(亦称卤水或卤汁)引入深达数米的贮卤池沉淀杂质,再经笕管导入纵向排列的数口铁锅中开始熬。
卤水先经大火煎煮,迅速蒸发水分,然后利用豆汁或蛋清、猪血等吸附硫酸钙等杂质,再用竹编的筛子舀起,称为“提浆”。
提浆之后的锅内盐卤“清澈见底”,之后用小火慢慢熬煮,适时下母子渣盐(盐种),促使卤水结晶成盐粒。
已经结晶的盐粒还需要经过淋花水的工序。
花水是一种卤汁,将卤汁一遍遍淋在刚刚结晶的盐粒上,洗去盐粒表面残留的杂质,增加盐粒的亮泽度。
之后滤去残留的水分,再转至烘干炕摊开烘干,最后打包、计重、入库房。
(1)“提浆”和实验室“过滤”一样,都是为了除去溶液中不溶性杂质,在实验室的过滤操作中必需要用到的玻璃仪器有烧杯、玻璃棒和____。
(2)熬盐和实验室的____原理相同。
(3)竹编的筛子相当于实验室的过滤操作中所用到的____。
(4)花水是氯化钠的____(填“饱和”或“不饱和”)溶液。
(5)氯化钠是重要的化工原料。
工业上通过电解饱和食盐水来大量制取烧碱, 同时得到二种副产物氢气和氯气,反应的化学方程式为____。
【答案】漏斗 蒸发 滤纸 饱和 2222NaCl 2H O2NaOH Cl H ++↑+↑通电 【解析】【分析】【详解】(1)过滤过程中用到玻璃仪器有烧杯玻璃棒漏斗,故填:漏斗;(2)熬盐和实验室蒸发的原理相同,故填:蒸发;(3)竹编的筛子起到过滤作用,相当于滤纸,故填:滤纸;(4)花水是一种卤汁,洗去盐粒表面残留的杂质,只去除杂质不溶解氯化钠,是氯化钠的饱和溶液,故填:饱和;(5)电解饱和食盐水制取烧碱, 同时得到副产物氢气和氯气,化学方程式为: 2222NaCl 2H O2NaOH Cl H ++↑+↑通电【点睛】 该题考察过滤操作的原理,及注意事项2.乙醇汽油,是指在汽油中按体积比加入一定比例(我国目前暂定为 10%)的变性燃料乙醇,通过特定工艺混配而成的新一代清洁环保型车用燃料。

2016年10月罗布泊盐湖卤水提取硫酸钾技术工艺解析李康(国投新疆罗布泊钾盐有限公司,新疆哈密839000)摘要:罗布泊处于我国新疆省若羌县镇罗布泊镇。
罗布泊也被称作死亡之海,我国当前西部大开发的战略有效的得到实施,主要目的就是将中西部的优势资源进行开发,使其成为我国重要的经济资源。
需要采取有效的技术,开发罗布泊地下的含钾卤水,从中提取出钾肥,促进我国西部大开发的发展,使我国边疆得到稳定。
关键词:罗布泊;盐卤水;硫酸钾罗布泊位于我国新疆的塔里木盆地的东部。
罗布泊可以从地下卤水中提取出卤水生产硫酸钾,但是我国罗布泊位置较偏僻,工作条件比较艰苦。
在罗布泊生产硫酸钾的时候,需要结合罗布泊常年高温、少雨的地理环境和资源特点,选择的工业流程需要适应当地的环境。
1罗布泊盐湖卤水提取硫酸钾的工艺流程和理论(1)卤水蒸发结晶路线(2)首先将罗布泊盐湖原始卤水(A点卤水)输送至氯化钠池,同时按盐田工艺要求兑入一定数量的老卤(E点卤水)得到B点卤水,由于同离子效应,兑卤时析出少量氯化钠;B点卤水日晒蒸发结晶析出氯化钠得Ep点卤水,然后自流至泻利盐池。
(3)Ep卤水在泻利盐池内蒸发结晶析出氯化钠和泻利盐,形成C点卤水,与来自加工厂的混合母液一起泵至钾混盐池。
(4)C点卤水和混合母液在钾混盐池蒸发、浓缩,析出钾混盐,形成D点卤水。
D点卤水泵至光卤石池。
(5)D点卤水在光卤石池内蒸发失水,析出光卤石,形成老卤。
得到的老卤(E点)大部分用于兑卤,其余排放至氯化镁池储存(系统平衡前无老卤排放)。
(6)盐田产出的钾混盐和光卤石分别采收送加工厂,加工厂脱卤后的母液分别返回钾混盐池和光卤石池。
盐田滩晒工艺流程图2分析罗布泊卤水制取硫酸钾过程2.1光卤石矿经分解、浮选、过滤制成粗钾光卤石分子式为KCl·MgCl2·6H2O,是不对称复盐,分解的目的是将光卤石矿中的mgcl2进入液相,得到单体氯化钾。
光卤石矿分解原理:光卤石加入分解母液为分解介质,分解母液的K+含量高,mg2+含量低。

盐卤点浆的基本要求和注意点三篇盐卤点浆的基本要求和留意点11,豆和水没有特定的比例2,煮豆浆时应大火,浆水不能太浓,太浓简单有焦糊味.3,煮开后在浆的温度降到90度时在点卤.最好用浸泡两天以上的盐卤点.4,盐卤的用量是依据大豆的品种,浆的温度,卤水的浓度,等等.5,点完卤后要有充分的涨浆时间,同时要留意保温.6,上榨时豆腐花不能打碎,动作要轻,要快.7,上榨后要依据出水快慢来定压榨时间,出水快要快压,出水慢要慢压.盐卤点浆的基本要求和留意点2豆制品制作的各种菜肴深受人们宠爱,利用各种豆类作物制作豆制品在我国已有数千年的历史,传统上用豆类作物制作豆干,麻腐等都是采纳传统工艺,家庭作坊式的经过一系列蒸煮,过滤、冷冻等工艺制作得到各种豆制品,这种家庭作坊式的生产只能小规模的生产,不能满足如今社会对豆类制品的大需求量。
豆制品中的卤制品是深受人们宠爱的一种菜肴,在制作卤制品过程中有一道工序是把食用盐添加到卤制品的原浆中,如今豆制品制作工厂中传统做法是由工人把食盐依据原浆料的多少往原浆中添加,然后边添加边搅拌,凭借工人的工作阅历,不断尝试原浆的咸度来掌握卤制品原浆的点浆度,但是这种依靠人工阅历给卤制品原浆点浆的方法首先是不够精准,人工添加食盐的加入量不好掌握,其次是每次添加后都要人工搅拌劳动强度也较大,不利于工厂的标准化生产。
有用新型内容本有用新型所要解决的技术难题是提供一种盐卤点浆专用装置,它用在卤制品点浆过程中,能掌握食盐的加入按标准量添加,保证了卤制品的口味纯正,减轻了工人的劳动强度。
技术方案为了解决上述技术问题,本有用新型设计一种盐卤点浆专用装置,其特征在于它包括盐卤加注器,盐卤加注器上装有出料掌握阀,盐卤加注器与搅拌装置连接在一起。
所述盐卤加注器通过橡皮管道连接到盐卤池。
所述搅拌装置上的搅拌杆为叶轮样子,搅拌杆安装在搅拌掌握电机6上。
通过出料掌握阀掌握盐卤的加注量,往原料池中加注盐卤后用搅拌装置搅拌,边加注边搅拌实现了标准化掌握。

制盐工艺流程盐田饱和卤水直接进蒸发罐真空制盐工艺介绍靳志玲(中盐制盐工程技术研究院,天津 300450)真空精制盐1 简介目前,国内大部分井矿盐企业采用以井矿盐卤为原料,北方部分生产企业采用原盐化成饱和盐水再精制真空盐的生产方法。
随着国内“两碱”的迅速发展和人民生活水平的提高,原盐供需矛盾已越来越突出。
特别是在海盐区,以原盐溶解成饱和卤水再生产精制盐,不仅增加了原盐的消耗,而且降低了盐田面积的使用效率,增加投资,生产成本高,不同程度上影响了食用盐生产企业的经济效益,造成许多食用盐定点生产企业减产、亏损,直接影响了百姓的生活。
而采用滩田饱和卤水直接进蒸发罐制盐,即可以节约结晶面积,其母液还可以为生产氯化钾、氯化镁等盐化工产品提供高质量原料苦卤,达到充分利用卤水中的各种有效成分,实现零排放、无污染、循环经济的目的。
2. 工艺流程简述卤水经滩田日晒蒸发,至饱和后引入一个卤水库中储存。
卤水库的作用,一是储存一定量的饱和卤水,以备真空制盐生产的需要;二是卤水在此有一定的停留时间,可以使其中的一些杂质颗粒沉淀下来,达到净化卤水的目的。
净化后的饱和卤水从卤水库引出后,进入蒸发制盐车间的精卤桶。
采用预热后的卤水进罐,顺流转料、末效排盐浆,集中排母液的方式进行生产。
I效蒸发罐盐箱中的盐排到II效下循环管中,II效盐箱中的盐排到III效下循环管中,III效盐箱中的盐排到IV效下循环管中,最后集中在IV效盐箱;IV效排出盐浆,同时由IV效分离罐排出母液。
工艺流程简图见图1。
13. 工艺的优缺点运用该工艺已在中国北方建设了一个年产15万吨的真空制盐生产线,相比再制盐生产工艺,其实施效果如下:本工艺采用饱和卤水制盐,不需要淡水化原盐,淡水消耗低,可节约淡水资源,根据生产情况,1t盐消耗淡水1.4-0.2m3,而再制盐生产工艺需要淡水3.5-4.53.73m3,吨盐节约了2.1-4.3 m3淡水。
2)节约日晒盐场土地,减少原盐消耗,提高了盐田利用率对再制盐生产线来说,一般生产1t精制盐需要消耗1.2t日晒原盐,年产15万t的精制盐需要18万t原盐,需要结晶面积136.36公顷(按目前中国北方盐场有效结晶单产1650t/公顷,有效面积占80,),采用饱和卤水直接进蒸发罐工艺,不需要饱和卤水进结晶池继续蒸发制盐,只需要建设一个约2公顷的饱和卤库,因此,节约了土地面积134.36公顷,节省的结晶面积可用于增加日晒盐产量8547t,按日晒盐销售价160元/t计算,日晒盐增加产值136.8万元。

盐田饱和卤水直接进蒸发罐真空制盐工艺介绍靳志玲(中盐制盐工程技术研究院,天津300450)内容摘要:利用滩田饱和卤水直接进蒸发罐蒸发结晶制取氯化钠,在制盐过程中采取三次洗涤方法,除去钙镁离子,以获得纯度超过99.1%的氯化钠和浓度较高的制盐母液。
关键词:滩田饱和卤水真空精制盐1 简介目前,国内大部分井矿盐企业采用以井矿盐卤为原料,北方部分生产企业采用原盐化成饱和盐水再精制真空盐的生产方法。
随着国内“两碱”的迅速发展和人民生活水平的提高,原盐供需矛盾已越来越突出。
特别是在海盐区,以原盐溶解成饱和卤水再生产精制盐,不仅增加了原盐的消耗,而且降低了盐田面积的使用效率,增加投资,生产成本高,不同程度上影响了食用盐生产企业的经济效益,造成许多食用盐定点生产企业减产、亏损,直接影响了百姓的生活。
而采用滩田饱和卤水直接进蒸发罐制盐,即可以节约结晶面积,其母液还可以为生产氯化钾、氯化镁等盐化工产品提供高质量原料苦卤,达到充分利用卤水中的各种有效成分,实现零排放、无污染、循环经济的目的。
2. 工艺流程简述卤水经滩田日晒蒸发,至饱和后引入一个卤水库中储存。
卤水库的作用,一是储存一定量的饱和卤水,以备真空制盐生产的需要;二是卤水在此有一定的停留时间,可以使其中的一些杂质颗粒沉淀下来,达到净化卤水的目的。
净化后的饱和卤水从卤水库引出后,进入蒸发制盐车间的精卤桶。
采用预热后的卤水进罐,顺流转料、末效排盐浆,集中排母液的方式进行生产。
I效蒸发罐盐箱中的盐排到II效下循环管中,II效盐箱中的盐排到III效下循环管中,III效盐箱中的盐排到IV效下循环管中,最后集中在IV效盐箱;IV效排出盐浆,同时由IV效分离罐排出母液。
工艺流程简图见图1。
3. 工艺的优缺点运用该工艺已在中国北方建设了一个年产15万吨的真空制盐生产线,相比再制盐生产工艺,其实施效果如下:本工艺采用饱和卤水制盐,不需要淡水化原盐,淡水消耗低,可节约淡水资源,根据生产情况,1t盐消耗淡水 1.4-0.2m3,而再制盐生产工艺需要淡水3.5-4.53.73 m3,吨盐节约了2.1-4.3 m3淡水。

制盐生产原盐、加工盐及综合利用盐卤资源的工业部门。
生产范畴包括:纳取海水、盐湖卤水或地下卤水,在盐田内日晒成盐;钻井汲取地下天然卤水或注水溶解地下岩盐得到的卤水,用圆锅、平锅加热煎煮或用真空、热压蒸发、浓缩成盐;钻井水溶开采地下岩盐,生产直接用作制碱原料的卤水;直接采出地下岩盐和盐湖中天然结晶的石盐;按用途对原盐进行加工;从制盐母液中提取其他化工产品。
制盐工业既是采掘工业,又是加工工业。
盐的生产常集中在部分地区,销售遍及各地。
盐是最古老的商品之一。
制盐工业在国民经济中占有重要的经济地位,是国民经济的重要组成部分。
盐是人类生活的必需品,是化学工业的基本原料,在其他工业部门和农牧渔业中也有广泛用途。
盐税曾经是许多国家重要的财政收入。
沿革制盐工业历史悠久,其发展经历了由原始手工生产、手工机械生产到机械化、现代化生产的过程(见制盐技术史)。
人类最早是采集自然界存在的卤水和盐,包括地表天然卤水和岩盐及海滨洼地自然结晶的盐,供给食用。
中国在5000多年前,就开始刮取海滨咸土,淋卤煎盐。
有天然卤水的地区,曾采用“先烧炭,以盐井水泼之,刮取盐”的生产方法。
战国末期,四川开始掘井、汲卤、煎盐。
齐管仲(公元前?~前645)实行“官山海”政策,即盐由官民并制,产品全部由官府统一运销。
但由汉代至明代,除隋文帝开皇三年(583)到唐玄宗开元十年(722)的139年间,开放全国海滩、盐井、盐湖,任民自由产销外,其他历代为了增加财政收入,大都实行专卖制度,以严刑峻法控制着盐的产销,以徭役的形成强迫盐户产盐,生产者役作极苦,还要负担繁重的盐课,因而严重地阻碍了生产的发展。
虽然隋、唐之际,山西湖盐生产已形成“垦畦浇晒”的新工艺,宋、元之际,福建海盐生产已部分采用晒盐法,但生产规模小,工具设备简陋,生产者之间只有简单的协作,一直停留在一家一户的小生产状态。
井矿盐的情况有所不同。
四川在宋代出现了卓筒井,首次使用钻头(“圜刃”锉)凿井。

盐卤厂的工艺流程
盐卤厂工艺流程
盐卤是一种由海水或地下卤水中提取的含有氯化钠和其他溶解盐的液体。
盐卤厂是将盐卤加工成精制食盐的工厂。
一、盐卤提取
盐卤的提取通常从海水或地下卤水开始。
海水中含有大量的盐分,而地下卤水则是长期积累而成的富含盐分的地下水源。
首先,将海水或地下卤水引入到盐田中,利用盐田的天然蒸发和人工蒸发的方式,使水分蒸发,盐分逐渐浓缩。
在蒸发过程中,要注意控制温度和风速,以保证盐分浓缩的均匀性和高度。
二、盐卤处理
经过蒸发后得到的盐卤需要经过处理才能得到精制的食盐。
首先进行固体去除,通过过滤和沉淀等方式,将杂质和悬浮物从盐卤中去除。
随后进行软化处理,将盐卤中的硬度离子(如钙、镁离子)去除,减少水垢的生成。
这一步通常采用离子交换器,将盐卤中的钠离子与硬度离子交换,使盐卤软化。
三、结晶
经过处理的盐卤接下来需要进行结晶。
结晶是将盐卤中的溶解盐分无序地排列组成有序固体盐晶的过程。
常用的结晶方法有真空结晶和蒸发结晶。
真空结晶是利用物质在低压下的蒸发点
降低,通过调节压力和温度,使盐卤中的饱和度达到结晶的条件;蒸发结晶则是通过加热和蒸发,使盐卤中水分蒸发,盐分逐渐结晶。
四、结晶分级
结晶过程中可以得到的是多级结晶产物,即不同品质和颗粒大小的盐分。
为了得到符合市场需求的食盐,需要对结晶产物进行分级。
通过不同的筛网和振动台,将盐晶按照颗粒大小进行分级。
同时,也可以根据产物的品质和纯度进行分级和分类,以满足不同的市场需求。
五、精制与包装
结晶分级后得到的盐晶需要进行进一步精制。
常用的精制方法有除杂、漂白和除湿。
除杂是将盐晶中的杂质和颗粒进一步去除,使产品更加纯净;漂白是通过添加氯活化剂或过滤,去除盐晶中的有色杂质,使盐晶呈现纯白色;除湿是将盐晶的水分含量控制在符合规定的范围内。
最后,经过精制的盐晶进行包装。
包装可以根据市场需求进行不同形式和规格的包装,如塑料袋、纸袋、桶装等。
在包装过程中,要注意卫生和质量控制,确保产品符合卫生标准和质量要求。
总体来说,盐卤厂的工艺流程主要包括盐卤提取、盐卤处理、
结晶、结晶分级、精制和包装等环节。
每一个环节都需要控制好温度、压力和物质浓度等因素,以确保产品质量和卫生安全。