1根据道尔顿分压定律Bpp可见压力具有加和性
- 格式:pdf
- 大小:95.44 KB
- 文档页数:2

道尔顿分压定律科技名词定义中文名称:道尔顿分压定律英文名称:Dalton law of additive pressure定义:理想气体混合物的总压力为各组元气体分压力之和。
所属学科:电力(一级学科);通论(二级学科)本内容由全国科学技术名词审定委员会审定公布描述的是理想气体的特性。
这一经验定律是在1801年由约翰·道尔顿所观察得到的。
在任何容器内的气体混合物中,如果各组分之间不发生化学反应,则每一种气体都均匀地分布在整个容器内,它所产生的压强和它单独占有整个容器时所产生的压强相同。
目录编辑本段简介道尔顿分压定律(也称道尔顿定律)描述的是理想气体的特性。
这一经验定律是在1801年由约翰·道尔顿所观察得到的。
在任何容器内的气体混合物中,如果各组分之间不发生化学反应,则每一种气体都均匀地分布在整个容器内,它所产生的压强和它单独占有整个容器时所产生的压强相同[1]。
也就是说,一定量的气体在一定容积的容器中的压强仅与温度有关。
例如,零摄氏度时,1mol 氧气在 22.4L 体积内的压强是 101.3kPa 。
如果向容器内加入 1mol 氮气并保持容器体积不变,则氧气的压强还是101.3kPa,但容器内的总压强增大一倍。
可见, 1mol 氮气在这种状态下产生的压强也是 101.3kPa 。
道尔顿[2](Dalton)总结了这些实验事实,得出下列结论:某一气体在气体混合物中产生的分压等于在相同温度下它单独占有整个容器时所产生的压力;而气体混合物的总压强等于其中各气体分压之和,这就是气体分压定律(law of partial pressure)。
需要注意的是,实际气体并不严格遵从道尔顿分压定律,在高压情况下尤其如此。
当压力很高时,分子所占的体积和分子之间的空隙具有可比性;同时,更短的分子间距离使得分子间作用力增强,从而会改变各组分的分压力。
这两点在道尔顿定律中并没有体现。
编辑本段人物英国科学家约翰·道尔顿在19世纪初把原子假说引入了科学主流。

证明道尔顿分压定律物理学是一门研究物质及其运动规律的学科,其中动态平衡是物质运动过程中不可或缺的一部分。
在研究物质的动态平衡过程中,道尔顿分压定律被广泛应用。
本文将详细介绍道尔顿分压定律的证明过程,希望能对物理学学习者有所帮助。
一、道尔顿分压定律的定义道尔顿分压定律是指,在混合气体中,各个组成气体所产生的压力,等于它们在混合气体中各自明压的压力之和。
即P = P1 + P2 + … + Pn。
其中P为混合气体的总压力,P1、P2、…、Pn为不同组分气体各自明压。
二、证明过程在一定体积内的混合气体中,假设有n种分子分别为A1、A2、...、An。
以Ai气体分子为研究对象,根据动理学理论,它们在该体积内的压力等于它们在该体积内行动所产生的撞击力之和。
即Pi = nAi * mi * g / V。
其中nAi为Ai分子在体积内的密度,mi为Ai分子的质量,g为重力加速度,V为体积。
所以,对于整个混合气体而言,混合气体的压力为P = P1 + P2 + … + Pn。
将该式化简可得P = n * m * g / V。
其中n、m均为混合气体的密度与平均分子质量。
得到该式后,我们可以将其归一化。
将该式除以混合气体的总分子数N得到P / N = (n1 / N) * m1 * g / V + (n2 / N) * m2 * g / V + ... + (nn / N) * mn * g / V。
其中n1 / N, n2 / N, ... , nn / N为各个气体在混合气体中所占的比重,即它们的摩尔分数。
将式子简化后,我们可以得到P / N = P1 / N + P2 / N + ... + Pn / N。
在等号两侧同时乘以混合气体的分子数,即P = N * P1 / N + N * P2 / N + ... + N * Pn / N,其中N * ni / N为混合气体中各分子数。
三、结论阐述由以上证明过程可以看出,当混合气体的分子数一定时,各个气体分子所产生的压力之和即为混合气体的总压力。

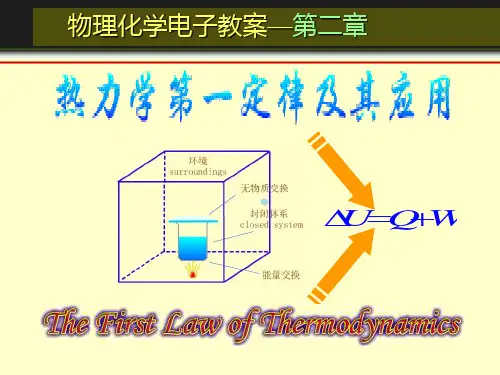
第2章 热力学第一定律思考题:1. 对一定量的理想气体,下列单纯PVT 过程是否可能:① 等温下绝热膨胀。
② 等压下绝热压缩。
③ 体积不变,而温度上升,且过程绝热。
④ 吸热而温度不变。
⑤ 温度不变,且压力不变。
2. 在一个带有无摩擦、无质量的绝热活塞的绝热气缸内充入一定量的气体。
气缸内壁绕有电阻丝,活塞上方施以一恒定压力,并与缸内气体成平衡状态,如图所示。
现通入一微小电流,使气体缓慢膨胀。
此过程为一等压过程,故Q p =ΔH ,该系统为一绝热系统,则Q p =0,所以此过程的ΔH=0。
此结论对否?3. 已知下述反应的Θ∆m r H :① C(石墨) + 0.5 O 2(g) == CO(g) )(I H mr Θ∆ ② CO+ 0.5 O 2(g) == CO 2(g) )(II H mr Θ∆ ③ H 2(g) + 0.5 O 2(g) == H 2O(g) )(III H mr Θ∆ ④ 2H 2(g) + O 2(g) == 2H 2O(l) )(IV H mr Θ∆ (i) )(I H m r Θ∆,)(II H m r Θ∆,)(III H m r Θ∆,)(IV H m r Θ∆是否分别是CO(g) ,CO 2(g) ,H 2O(g), H 2O(l)的Θ∆m f H ?(ii) )(I H mr Θ∆,)(II H m r Θ∆,)(III H m r Θ∆是否分别是C(石墨),CO 2(g),H 2(g)的Θ∆m C H ?4. 什么情况下,一个化学反应的Θ∆m r H 不随温度变化?选择题:1. 绝热水箱中装有水,水中绕有电阻丝,由蓄电池供给电流。
假设电池放电过程中无热效应,通电后电阻丝和水的温度皆有升高。
A .Q=0,W<0,ΔU<0 B. Q<0,W>0,ΔU>0 C .Q>0,W=0,ΔU>0D. Q=0,W>0,ΔU>0E. Q<0,W=0,ΔU<0① 以电池为系统,水和电阻丝为环境,上述正确的是② 以电阻丝为系统,水和电池为环境,上述正确的是③ 以水为系统,电阻丝和电池为环境,上述正确的是④ 以水和电阻丝为系统,电池为环境,上述正确的是⑤ 以电池和电阻丝为系统,水为环境,上述正确的是2. 使公式p p Q H =∆成立的条件是A 开放体系,只作膨胀功,P 体=P 外=常数B 封闭体系,可作任何功,P 体=P 外=常数C 封闭体系,只作有用功,P 体=P 外=常数D 封闭体系,只作膨胀功,P 体=P 外=常数E 封闭体系,只作膨胀功,P 始=P 终=P 外=常数3. 根据热力学第一定律,关于封闭体系的描述正确的是A. 吸热Q 是状态函数B. 对外做功W 是状态函数C. Q-W 是状态函数D. 热力学能U 是状态函数4. 下列说法,哪一种不正确?A. 焓只有在特定条件下,才与系统吸热相等B. 焓是人为定义的一种具有能量量纲的热力学量C. 焓是状态函数D. 焓是体系可以与环境进行热交换的能量5.下列说法正确的是A. 热容C不是状态函数B. 热容C与途径无关C. 恒压热容C p不是状态函数D. 恒容热容C v不是状态函数6.某体系经历一不可逆循环后,下列说法错误的是A. Q=0B. W=0C. ΔU=0D. ΔC p=0E. ΔC v=0F. ΔH=07.公式ΔU=Q+W适用于什么体系A. 开放体系B. 封闭体系C. 孤立体系8.下列说法正确的是A. 理想气体经历绝热自由膨胀后,其热力学能变化为零;B. 非理想气体经历绝热自由膨胀后,其热力学能变化不一定为零;C. 非理想气体经历绝热自由膨胀后,其温度不一定降低。

1.熵增加的放热反应是自发反应。
(×)2.第二类永动机是从单一热源吸热而循环不断对外作功的机器。
(×)3.在克拉贝龙方程中:dP/dT=ΔH/TΔV,ΔH和ΔV的符号可相同或不同。
(√)4.公式dS=nCVlnT2/T1只适用于理想气体的变温过程。
(×)5.因为ΔGθ=-RTlnK中,K是由平衡时的组成表示的,所以ΔGθ表示平衡时产物与反应物吉布斯自由能之差。
(×)6.因为Q,W不是系统的性质,而与过程有关,所以热力学过程中(Q-W)的值也应由具体过程决定。
(×)7.熵差ΔS就是过程的热温商。
(×)8.在孤立系统中发生的任何过程都是自发过程。
(√)9.可逆绝热过程必定是等熵过程。
(√)10.同一物质,当温度升高时,熵值增大。
(√)21.一定量的理想气体由0℃、200kPa的始态反抗恒定外压(p环=100kPa)绝热膨胀达平衡,则末态温度不变。
(×)23.在等压下,机械搅拌绝热容器中的液体,使其温度上升,则ΔH=Qp=0。
(×)24.对于同一始态出发的理想气体的绝热变化过程,W R=ΔU=n Cv,mΔT,W r =ΔU =n Cv,mΔT,所以W R=W r。
(×)25.自然界发生的过程一定是不可逆过程。
(√)26.溶液的化学势等于溶液中各组分化学势之和。
(×)27.熵增加的过程一定是自发过程。
(×)28.绝热可逆过程的∆S=0,绝热不可逆膨胀过程的∆S>0,绝热不可逆压缩过程的∆S<0。
(×)29.为了计算绝热不可逆过程的熵变,可以在始末态之间设计一条绝热可逆途径来计算。
(×)30.在同一稀溶液中组分B的浓度可用x B、m B、c B表示,因而标准态的选择是不相同的,所以相应的化学势也不同。
(×)31.水溶液的蒸气压一定小于同温度下纯水的饱和蒸气压。

第一章 思考题1.根据道尔顿分压定律B p p =∑。
可见压力具有加和性,应属于广度性质,此结论对吗?何故?2.指出下列公式适用的条件:(1)dU Q pdV δ=−(2)H U pV =+(3);p V H Q U Q Δ=Δ=(4)21T p T H C dT Δ=∫和 21T V T U C dT Δ∫(5)21lnV W nRT V = (6)W p V =Δ(7)常数pV γ=(8)11221p V p V W γ−=− (9)12()1nR W T T δ=−− 3.判断下列说法是否正确:(1)状态固定后,状态函数都固定,反之亦然。
(2)状态函数改变后,状态一定改变。
(3)状态改变后,状态函数一定都改变。
(4)因为,V U Q Δ=p H Q Δ=,所以是特定条件下的状态函数。
,V P Q Q (5)恒温过程一定是可逆过程。
(6)气缸内有一定量的理想气体,反抗一定外压作绝热膨胀,则。
0p H Q Δ== (7)根据热力学第一定律,因为能量不能无中生有,所以一个体系若要对外作功,必须从外界吸收能量。
(8)体系从状态Ⅰ变化到状态Ⅱ,若0T Δ=则0Q =,无热量交换。
(9)在等压下,机械搅拌绝热容器中的液体,使其温度上升,则。
0p H Q Δ== (10)理想气体绝热变化过程中W (可逆) =V C T −Δ, W (不可逆) =,所以W (绝热可逆)=W (绝热不可逆)。
V C T −Δ (11)一封闭体系,当始终态确定后:(a )若经历一个绝热过程,则功有定值;(b )若经历一个等容过程,(设0f W =),则Q 有定值;(c )若经历一个等温过程,则内能有定值;(d )若经历一个多方过程,则热和功的差值有定值。
4.回答下列问题:(1)用1:3的N 2和H 2在反应条件下合成氨,实验测得在和时放出的热量分别为和,用基尔霍夫定律验证时发现与下述公式不符,试解释原因?1T 2T 1()p Q T 2()p Q T 2121()()T r m r m r p T H T H T C d Δ=Δ+Δ∫T (2)从同一始态A 出发经三种不同途径到达不同终态,经等温可逆 ,经绝热不可逆:A B →A D → (a)若终态体积相同,问D 点位于BC 线上什么位置?(b)若终态压力相同,问D 位于BC 线上什么位置?图 (a) 图 (b)。

道尔顿定律又称混合气体分压定律,是由英国化学家和物理学家道尔顿(J.John Dalton)提出来的。
该定律表明了各组分气体压力的相互独立和可线性叠加的性质,即相互不起化学作用的混合气体的总压力等于各组成气体分压力之和。
用数学式表达为:
P=P1+P2+…Pn
式中:P表示混合气体总压力,P1、P2、Pn表示各组成气体的分压力。
例如氨冷凝器中,氨气的分压力为1.28MPa,空气的分压力为0.11MPa,则总压力P=1.28+0.11=1.391MPa,也就是说氨制冷系统中混入空气后,会使压缩机的排气压力升高,故必须经常放空气。
从冷凝器上压力表的读数,以及从冷凝器下部测得的液态制冷剂的温度,可估算出冷凝器中空气的分压力。



道尔顿分压定律的两种描述方式1. 什么是道尔顿分压定律?好啦,今天咱们来聊聊一个科学界的老朋友——道尔顿分压定律。
听名字可能有点儿高大上,但实际上,它说的就是气体混合物里每种气体的“压力”问题。
简单来说,就是每种气体都在“偷偷”施加自己的压力,像个小演员在舞台上争着出风头。
想象一下,在一个聚会上,大家都在说话,气氛热闹,但每个人的声音其实都是独立的。
这就是道尔顿分压定律的基本思想:在一个气体混合物中,各种气体的压力相加,等于整个混合物的总压力。
1.1 公式简单理解这条定律的数学表达式也很简单,记住公式就行了。
总压力(P)等于各个分压力的总和(P₁ + P₂ + P₃ + ...)。
就像你在聚会上计算开销,如果你请了五个人,每个人都吃了一碗面,那么总费用就是五碗的价格加起来。
没啥复杂的,都是小道理!1.2 生活中的例子比如说,空气就是一个气体混合物,里面有氮、氧,还有二氧化碳等等。
每种气体的分压力就像各自的小小“地盘”,在这个大家庭里互相影响又互不干扰。
你可以想象,当你呼吸的时候,肺里吸入的氧气、氮气和其他气体,它们各自都在“努力工作”,帮你维持生命。
真是奇妙无比,对吧?2. 道尔顿分压定律的应用说到应用,哇,真是多得数不胜数!从工业到生活,分压定律几乎无处不在。
就像一个万能的调味品,让我们的生活更加丰富多彩。
2.1 科学实验中的神奇在实验室里,科学家们经常利用道尔顿分压定律来分析气体的成分。
比如,他们可能会用气相色谱法来分离混合气体,借助于不同气体的分压力进行分析。
这就像做一道精致的菜,先把每种调料单独放好,再按照比例混合,最后才能做出美味的佳肴。
2.2 日常生活的隐秘角色不仅如此,这个定律在我们的日常生活中也扮演着重要角色。
例如,潜水员在水下时,周围的水压力会影响他们吸入的气体。
这时候,分压定律就显得尤为重要了,潜水员们得根据水下环境调整气体配比,确保安全,真是“知己知彼,百战不殆”啊。
3. 两种描述方式的比较最后,我们来看看道尔顿分压定律的两种描述方式。

第一章热力学第一定律1.“根据道尔顿分压定律p=∑B p B压力具有加和性,因此是广延性质。
”这一结论正确否?为什么?答:不对。
压力与温度一样是强度性质。
不具有加和性,所谓加和性,是指一个热力学平衡体系中,某物质的数量与体系中物质的数量成正比,如C p=∑n B C p,m(B)。
而道尔顿分压定律中的分压p B是指在一定温度下,组分B单独占有混合气体相同体积时所具有的压力。
总压与分压的关系不是同一热力学平衡体系中物量之间的关系,与物质的数量不成正比关系,故p=∑p B不属加和性。
本题所犯错误是把混和气体中总压p与各组分分压p B关系误认为是热力学平衡体系中整体与部分的关系。
2.“凡是体系的温度升高时就一定吸热,而温度不变时,体系既不吸热也不放热”,这种说法对否?举实例说明。
答:不对。
例如:绝热条件下压缩气体,体系温度升高,但并未从环境中吸热。
又如:在绝热体容器中,将H2SO4注入水中,体系温度升高,但并未从环境吸热。
再如:理想气体等温膨胀,从环境吸了热,体系温度并不变化。
在温度不变时,体系可以放热或吸热,相变时就是这样。
例如水在1atm、100℃下变成水蒸气,温度不变则吸热。
3.-p(外)d V与-p(外)ΔV有何不同?-pV就是体积功,对吗?为什么在例2中-pV m(g)是体积功?答:-p(外)d V是指极其微小的体积功。
-p(外)ΔV是在指外压不变的过程体积功。
即在外压p不变的过程中体积由V1变化到V2(ΔV=V2-V1)时的体积功。
-pV不是体积功,体积功是指在外压(p外)作用下,外压p与体积变化值(d V)的乘积。
V与d V是不同的,前者是指体系的体积,后者是体积的变化值。
体积变化时才有体积功。
例2中的-pV m(g)实为-p[V m(g)-V m(l)],在这里忽略了V m(l),这里的V m(g)实为ΔV=V m(g)-V m(l),因此-pV m是体积功。
4.“功、热与内能均是能量,所以它们的性质相同”这句话正确否?答:不正确。
道尔顿分压定律(也称道尔顿定律)描绘的是理想气体的特征。
这一经验定律是在1 801 年由约翰·道尔顿所察看获得的。
在任何容器内的气体混淆物中,假如各组分之间不发生化学反响,则每一种气体都平均地散布在整个容器内,它所产生的压强和它独自据有整个容器时所产生的压强同样[1]。
也就是说,必定量的气体在必定容积的容器中的压强仅与温度相关。
比如,零摄氏度时,1mol氧气在体积内的压强是。
假如向容器内加入1mol氮气并保持容器体积不变,则氧气的压强仍是,但容器内的总压强增大一倍。
可见,1mol氮气在这类状态下产生的压强也是。
道尔顿[2]( Dalton )总结了这些实验事实,得出以下结论:某一气体在气体混淆物中产生的分压等于在同样温度下它独自据有整个容器时所产生的压力;而气体混淆物的总压强等于此中各气体分压之和,这就是气体分压定律(law of partial pressure )。
需要注意的是,实质气体其实不严格遵照道尔顿分压定律,在高压状况下特别这样。
当压力很高时,分子所占的体积和分子之间的缝隙拥有可比性;同时,更短的分子间距离使得分子间作使劲加强,进而会改变各组分的分压力。
这两点在道尔顿定律中并无表现。
§拉乌尔定律和亨利定律 -- 溶液的蒸气压力我们知道,液体能够蒸发成气体,气体也能够凝固为液体。
在必定的温度下,两者能够完成均衡,即液体的蒸发速度等于蒸气的凝固速度。
达到这种均衡时,蒸气有必定的压力,这个压力就叫做此液体的饱和蒸气压(简称蒸气压)。
蒸气压与温度相关,温度越高,分子拥有的动能越大,蒸发速度越快,因此蒸气压越大。
溶液的蒸气压除与温度相关外,还与浓度相关。
拉乌尔定律和亨利定律所描绘的就是溶液蒸气压和浓度之间的关系。
拉乌尔定律1887 年法国物理学家拉乌尔(Raoult )在溶液蒸气压实验中总结出有名的拉乌尔定律。
拉乌尔定律指出:假如溶质是不挥发性的,即它的蒸气压极小,与溶剂对比能够忽视不计,则在必定的温度下,稀溶液的蒸气压等于纯溶剂的蒸气压与其克分子分数的乘积。
热力学第一定律试题(一)填空题(每题2分)1.1-1-1-9 理想气体等温可逆膨胀过程,ΔU 0,ΔH 0,Q 0,W 0。
(填>、=、<)2.1-1-1-11 气体分子数增加的反应,在恒容无非体积功的条件下,ΔU ΔH,ΔH Q,ΔU Q,W 0。
(填>、=、<)3.1-1-1-9 将热量Q传给一定量的理想气体,(1)若体积不变,则这热量转变为;(2)若温度不变,则这热量转变为;(3)若压力不变,则这热量转变为。
4.1-1-1-9 在一个绝热箱内装有浓硫酸和水,开始中间用隔膜分开,然后弄破隔膜,使水和浓硫酸混合,以水和浓硫酸为体系,则Q 0,W 0,ΔU 0。
(填>、=、<)5.1-1-1-13 1mol液态苯在298K时置于恒容氧弹中完全燃烧,生成水和二氧化碳气体,同时放热3264KJ·mol-1。
则其等压燃烧热为。
6.1-1-1-13 反应C(石墨) + O2 CO2(g)的ΔH,是CO2(g)的热,是C(石墨)的热。
7.1-1-1-9 有3molH2(可视为理想气体),由298K加热到423K,则此过程的ΔU为。
8.1-1-1-9 1mol双原子理想气体,从温度300K绝热压缩到500K,则焓变为。
^9. 1-1-1-3 体系经历不可逆循环后,ΔU 0,ΔH0。
(二)选择题(每题1分)10.1-4-2-1 有一敞口容器中放有水溶液,如果以此溶液为体系,则为:()(A) 孤立体系(B) 封闭体系(C) 敞开体系(D) 绝热体系11.1-4-2-1把一杯水放在刚性绝热箱内,若以箱内热水及空气为体系,则该体系为:()(A) 敞开体系(B) 封闭体系(C)孤立体系(D)绝热体系12.1-4-2-2 以下性质为容量性质的是()(A) 温度(B) 密度(C) 压力(D) 体积13.1-4-2-2 以下性质为强度性质的是()(A) 内能(B) 温度(C) 体积(D) 焓·14.1-4-2-3下列不符合热力学平衡状态含义的叙述是()(A) 系统内各部分之间及系统与环境间有不平衡作用力存在(B) 系统内部各处温度相同,且不随时间变化(C) 当系统内有化学反应发生并达到平衡时,系统的物质组成不随时间变化(D) 系统内相数及各相组成不随时间变化15.1-4-2-3 有关状态函数的描述不正确的是()(A) 状态一定,值一定;(B) 在数学上有全微分的性质;(C) 其循环积分等于零;(D) 所有状态函数的绝对值都无法确定。
《物理化学》第二章-热力学第一定律练习题(含答案)————————————————————————————————作者:————————————————————————————————日期:第二章练习题一、填空题1、根据体系和环境之间能量和物质的交换情况,可将体系分成、、。
2、强度性质表现体系的特征,与物质的数量无关。
容量性质表现体系的特征,与物质的数量有关,具有性。
3、热力学平衡状态同时达到四种平衡,分别是、、、。
4、体系状态发生变化的称为过程。
常见的过程有、、、、。
5、从统计热力学观点看,功的微观本质是,热的微观本质是。
6、气体各真空膨胀膨胀功W= 07、在绝热钢瓶中化学反应△U= 08、焓的定义式为。
二、判断题(说法对否):1、当体系的状态一定时,所有的状态函数都有一定的数值。
(√)2、当体系的状态发生变化时,所有的状态函数的数值也随之发生变化。
(χ)3.因= ΔH, = ΔU,所以与都是状态函数。
(χ)4、封闭系统在压力恒定的过程中吸收的热等于该系统的焓。
(χ)错。
只有封闭系统不做非膨胀功等压过程ΔH=Q P5、状态给定后,状态函数就有定值;状态函数确定后,状态也就确定了。
(√)6、热力学过程中W的值应由具体过程决定( √ )7、1mol理想气体从同一始态经过不同的循环途径后回到初始状态,其热力学能不变。
( √ )三、单选题1、体系的下列各组物理量中都是状态函数的是( C )A 、T、P、V、QB 、m、W、P、HC、T、P、V、n、D、T、P、U、W2、对于内能是体系的单值函数概念,错误理解是( C )A体系处于一定的状态,具有一定的内能B对应于某一状态,内能只能有一数值不能有两个以上的数值C状态发生变化,内能也一定跟着变化D对应于一个内能值,可以有多个状态3下列叙述中不具有状态函数特征的是(D )A体系状态确定后,状态函数的值也确定B体系变化时,状态函数的改变值只由体系的始终态决定C经循环过程,状态函数的值不变D状态函数均有加和性4、下列叙述中正确的是( A )A物体温度越高,说明其内能越大B物体温度越高,说明其所含热量越多C凡体系温度升高,就肯定是它吸收了热D凡体系温度不变,说明它既不吸热也不放热5、下列哪一种说法错误( D )A焓是定义的一种具有能量量纲的热力学量B只有在某些特定条件下,焓变△H才与体系吸热相等C焓是状态函数D焓是体系能与环境能进行热交换的能量6、热力学第一定律仅适用于什么途径(A)A同一过程的任何途径B同一过程的可逆途径C同一过程的不可逆途径D不同过程的任何途径7. 如图,将CuSO4水溶液置于绝热箱中,插入两个铜电极,以蓄电池为电源进行电解,可以看作封闭系统的是(A)(A) 绝热箱中所有物质; (B) 两个铜电极;(C) 蓄电池和铜电极;(D) CuSO4水溶液。
第二章练习题一、填空题1、根据体系和环境之间能量和物质的交换情况,可将体系分成、、。
2、强度性质表现体系的特征,与物质的数量无关。
容量性质表现体系的特征,与物质的数量有关,具有性。
3、热力学平衡状态同时达到四种平衡,分别是、、、。
4、体系状态发生变化的称为过程。
常见的过程有、、、、。
5、从统计热力学观点看,功的微观本质是,热的微观本质是。
6、气体各真空膨胀膨胀功W= 07、在绝热钢瓶中化学反应△U= 08、焓的定义式为。
二、判断题(说法对否):1、当体系的状态一定时,所有的状态函数都有一定的数值。
(√)2、当体系的状态发生变化时,所有的状态函数的数值也随之发生变化。
(χ)3.因= ΔH, = ΔU,所以与都是状态函数。
(χ)4、封闭系统在压力恒定的过程中吸收的热等于该系统的焓。
(χ)错。
只有封闭系统不做非膨胀功等压过程ΔH=Q P5、状态给定后,状态函数就有定值;状态函数确定后,状态也就确定了。
(√)6、热力学过程中W的值应由具体过程决定( √ )7、1mol理想气体从同一始态经过不同的循环途径后回到初始状态,其热力学能不变。
( √ )三、单选题1、体系的下列各组物理量中都是状态函数的是( C )A 、T、P、V、QB 、m、W、P、HC、T、P、V、n、D、T、P、U、W2、对于内能是体系的单值函数概念,错误理解是( C )A体系处于一定的状态,具有一定的内能B对应于某一状态,内能只能有一数值不能有两个以上的数值C状态发生变化,内能也一定跟着变化D对应于一个内能值,可以有多个状态3下列叙述中不具有状态函数特征的是(D )A体系状态确定后,状态函数的值也确定B体系变化时,状态函数的改变值只由体系的始终态决定C经循环过程,状态函数的值不变D状态函数均有加和性4、下列叙述中正确的是( A )A物体温度越高,说明其内能越大B物体温度越高,说明其所含热量越多C凡体系温度升高,就肯定是它吸收了热D凡体系温度不变,说明它既不吸热也不放热5、下列哪一种说法错误( D )A焓是定义的一种具有能量量纲的热力学量B只有在某些特定条件下,焓变△H才与体系吸热相等C焓是状态函数D焓是体系能与环境能进行热交换的能量6、热力学第一定律仅适用于什么途径(A)A同一过程的任何途径B同一过程的可逆途径C同一过程的不可逆途径D不同过程的任何途径7. 如图,将CuSO4水溶液置于绝热箱中,插入两个铜电极,以蓄电池为电源进行电解,可以看作封闭系统的是(A)(A) 绝热箱中所有物质; (B) 两个铜电极;(C) 蓄电池和铜电极;(D) CuSO4水溶液。
第一章 思考题
1.根据道尔顿分压定律B p p =∑。
可见压力具有加和性,应属于广度性质,此结论对吗?何故?
2.指出下列公式适用的条件:
(1)dU Q pdV δ=−
(2)H U pV =+
(3);p V H Q U Q Δ=Δ=
(4)21T p T H C dT Δ=∫和 2
1T V T U C dT Δ∫(5)21
ln
V W nRT V = (6)W p V =Δ(7)常数
pV γ=(8)11221p V p V W γ−=
− (9)12
()1nR W T T δ=−− 3.判断下列说法是否正确:
(1)状态固定后,状态函数都固定,反之亦然。
(2)状态函数改变后,状态一定改变。
(3)状态改变后,状态函数一定都改变。
(4)因为,V U Q Δ=p H Q Δ=,所以是特定条件下的状态函数。
,V P Q Q (5)恒温过程一定是可逆过程。
(6)气缸内有一定量的理想气体,反抗一定外压作绝热膨胀,则。
0p H Q Δ== (7)根据热力学第一定律,因为能量不能无中生有,所以一个体系若要对外
作功,必须从外界吸收能量。
(8)体系从状态Ⅰ变化到状态Ⅱ,若0T Δ=则0Q =,无热量交换。
(9)在等压下,机械搅拌绝热容器中的液体,使其温度上升,则。
0p H Q Δ== (10)理想气体绝热变化过程中W (可逆) =V C T −Δ, W (不可逆) =,
所以W (绝热可逆)=W (绝热不可逆)。
V C T −Δ (11)一封闭体系,当始终态确定后:
(a )若经历一个绝热过程,则功有定值;
(b )若经历一个等容过程,(设0f W =),则Q 有定值;
(c )若经历一个等温过程,则内能有定值;
(d )若经历一个多方过程,则热和功的差值有定值。
4.回答下列问题:
(1)用1:3的N 2和H 2在反应条件下合成氨,实验测得在和时放出的热量
分别为和,用基尔霍夫定律验证时发现与下述公式不符,试解释原因?
1T 2T 1()p Q T 2()p Q T 2
121()()T r m r m r p T H T H T C d Δ=Δ+Δ∫T (2)从同一始态A 出发经三种不同途径到达不同终态,经等温可逆 ,
经绝热不可逆:
A B →A D → (a)若终态体积相同,问D 点位于BC 线上什么位置?
(b)若终态压力相同,问D 位于BC 线上什么位置?
图 (a) 图 (b)。