1-2-1 阿马格分体积定律
- 格式:ppt
- 大小:36.00 KB
- 文档页数:6




第1讲气体的pVT 性质《物理化学》考点精讲教程(天津大学第五版)主讲人:张彩丽网学天地《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程四、物理化学课程的内容《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程二、气体常数《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程(1)指定状态下计算系统中各宏观性质。
《物理化学》(天大第五版)考点精讲教程(2)状态变化时,计算系统各宏观性质。
《物理化学》(天大第五版)考点精讲教程例:某空气《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 质量分数《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程5. 理想气体方程对理想气体混合物的应用《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 道尔顿分压定律《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程三、阿马格分体积定律《物理化学》(天大第五版)考点精讲教程物理意义:《物理化学》(天大第五版)考点精讲教程四、两者关系《物理化学》(天大第五版)考点精讲教程1. 指定状态下的计算《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 状态变化时的计算《物理化学》(天大第五版)考点精讲教程A,0200kPap=《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 性质《物理化学》(天大第五版)考点精讲教程二、临界参数c《物理化学》(天大第五版)考点精讲教程三、真实气体的《物理化学》(天大第五版)考点精讲教程1. T< T c,反映出液体的不《物理化学》(天大第五版)考点精讲教程2. T = T c《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程2. 波义尔温度《物理化学》(天大第五版)考点精讲教程二、范德华方程《物理化学》(天大第五版)考点精讲教程2. 体积修正《物理化学》(天大第五版)考点精讲教程三、维里方程《物理化学》(天大第五版)考点精讲教程《物理化学》(天大第五版)考点精讲教程二、压缩因子图任何Tr ,pr→0,Z→1(理想气体);T r较小时,p r↑,Z先↓,后↑,反映出气体低压易压缩,高压难压缩;T r 较大时,Z ≈1。




概念及术语BET 公式 BET formula1938年布鲁瑙尔(Brunauer)、埃米特(Emmett)和特勒(Teller)三人在兰格缪尔单分子层吸附理论的基础上提出多分子层吸附理论。
该理论与兰格缪尔理论的主要不同之处是吸附在固体表面的分子存在着范德华力仍可吸附其它分子,即形成多分子层吸附。
在吸附过程中不一定待第一层吸满后再吸附第二层。
第一层吸附的吸附热较大,相当于化学反应的吸附热,且不同于其它各层的吸附热;第二层以后的吸附热均相等且数值较小,仅相当于气体的冷凝热。
在此基础上,推出BET 公式如下:)}/)(1(1){/1()/()(***---=p p c p p p p c V V 单;其中V为被吸附物质的总体积,V(单)为单层饱和吸附时所需吸附质的体积,c 是与吸附热有关的常数,p*为指定温度下液态吸附质的饱和蒸气压。
BET 公式适用于相对压力p/p*=0.05~0.15的范围,超出此范围就会产生较大的偏差。
DLVO 理论 DLVO theory1941年由德查金(Darjaguin)和朗道(Landau)以及1948年由维韦(Verwey)和奥弗比克(Overbeek)分别提出的带电胶体粒子的稳定理论。
胶体粒子稳定的三个主要原因是,分散相粒子的带电、溶剂化作用以及布朗运动。
HLB 法 hydrophile-lipophile balance method一种表面活性剂的选用方法,是格里芬(Griffin)1945年提出来的。
HLB 代表亲水亲油平衡。
HLB 值越大表示该表面活性剂的亲水性越强。
例如,HLB 值在2~6的表面活性剂可作油包水型的乳化剂;而HLB 值在12~18的表面活性剂可作水包油型的乳化剂等。
pVT 性质 pVT property指气体的压力、体积和温度三种宏观性质。
不涉及到相变化及化学反应。
ζ电势 zeta potential见电动电势。
阿伏加德罗常数 Avogadro ’number1摩尔的任何物质所含的粒子效,称为阿伏伽德罗常数,其值为6.022045×1023”,通常以符号N A 或L 表示。

概念及术语BET 公式 BET formu l a1938年布鲁瑙尔(Bruna u er)、埃米特(Emmet t )和特勒(Telle r )三人在兰格缪尔单分子层吸附理论的基础上提出多分子层吸附理论。
该理论与兰格缪尔理论的主要不同之处是吸附在固体表面的分子存在着范德华力仍可吸附其它分子,即形成多分子层吸附。
在吸附过程中不一定待第一层吸满后再吸附第二层。
第一层吸附的吸附热较大,相当于化学反应的吸附热,且不同于其它各层的吸附热;第二层以后的吸附热均相等且数值较小,仅相当于气体的冷凝热。
在此基础上,推出BET 公式如下:)}/)(1(1){/1()/()(***---=p p c p p p p c V V 单;其中V为被吸附物质的总体积,V(单)为单层饱和吸附时所需吸附质的体积,c 是与吸附热有关的常数,p*为指定温度下液态吸附质的饱和蒸气压。
BET 公式适用于相对压力p/p*=0.05~0.15的范围,超出此范围就会产生较大的偏差。
DLVO 理论 DLVO theor y1941年由德查金(Darja g uin)和朗道(Landa u )以及1948年由维韦(Verwe y )和奥弗比克(Overb e ek)分别提出的带电胶体粒子的稳定理论。
胶体粒子稳定的三个主要原因是,分散相粒子的带电、溶剂化作用以及布朗运动。
HLB 法 hydro p hile -lipop h ile balan c e metho d一种表面活性剂的选用方法,是格里芬(Griff i n)1945年提出来的。
HLB 代表亲水亲油平衡。
HLB 值越大表示该表面活性剂的亲水性越强。
例如,HLB 值在2~6的表面活性剂可作油包水型的乳化剂;而HLB 值在12~18的表面活性剂可作水包油型的乳化剂等。
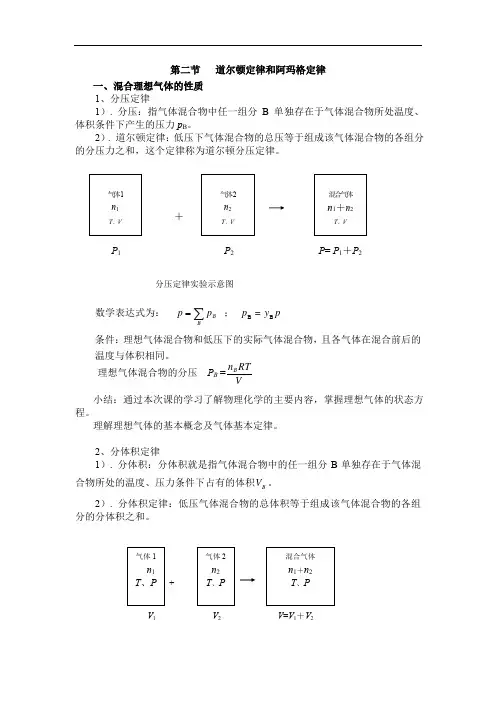
第二节 道尔顿定律和阿玛格定律 一、混合理想气体的性质
1、分压定律
1). 分压:指气体混合物中任一组分B 单独存在于气体混合物所处温度、体积条件下产生的压力p B 。
2). 道尔顿定律:低压下气体混合物的总压等于组成该气体混合物的各组分数学表达式为: ∑=B
B p p ; p y =p B B
条件:理想气体混合物和低压下的实际气体混合物,且各气体在混合前后的温度与体积相同。
理想气体混合物的分压 P B =
V
RT n B
小结:通过本次课的学习了解物理化学的主要内容,掌握理想气体的状态方程。
理解理想气体的基本概念及气体基本定律。
2、分体积定律
1). 分体积:分体积就是指气体混合物中的任一组分B 单独存在于气体混合物所处的温度、压力条件下占有的体积B V 。
2). 分体积定律:低压气体混合物的总体积等于组成该气体混合物的各组分的分体积之和。
+
V 1 V 2 V =V 1+V 2
+
P 1 P 2 P = P 1+P 2
分压定律实验示意图
气体1 n 1
T 、P 气体2 n 2 T 、P 混合气体 n 1+n 2 T 、P
气体 2 n 2 T 、V 混合气体 n 1+n 2
T 、V
气体 1
n 1
T 、V。

【P5】:1、理想气体模型(条件):1分子大小可以忽略,2:无分子作用力。
高温,低压状态的气体看做理想气体。
2、理想气体状态方程:PV二nRTP—压力—Pa V—体积—m3 n—物质的量—摩尔T—温度—温度—KR—摩尔气体常数—8.314[J/(mol*K)]【P7】:混合气体定律适用条件:理想气体的混合物1、道尔顿分压定律:某一气体在气体混合物中产生的分压等于在相同温度下它单独占有整个容器时所产生的压力;而气体混合物的总压强等于其中各气体分压之和,这就是气体分压定律。
Pa=naP/n =xaP2、阿马格定律:而气体混合物的总体积等于其中各体积之和,这就是气体分体积定律。
Va=naP/n=xaV Vi/V=ni/n=PiP【P15】:状态函数:只由体系状态确定的体系的各种热力学性质,称为体系的状态函数。
状态函数改变~状态改变。
状态改变~状态函数不一定改变。
(X\T) 常用的状态函数,T、P是强度性质;V、U、H、S、G广度性质。
热和功不是状态函数。
特征:殊途同归,值变相等。
周而复始,值变为零。
【P17:】功:非体积功,表面功、电功。
1、体积功:①向真空膨胀W=0,温度不变则热力学能保持不变。
∆T=0,Q=0,∆H=02、恒外压W=—P外∆V3、恒压P=P1=P2=P外:W=—P∆V④4、Wr=-nRTLn(V1/V2) (条件:理想、等温、可逆)【P23】:热力学可逆过程的特点:(可逆过程效率最高)(1)可逆过程是以无限小的变化进行的,体系始终无限接近于平衡态。
(2)循与过程原来途径相反的方向,可以使系统和环境完全恢复到原来的状态,而无任何耗散效应。
(3)在等温可逆膨胀过程中系统对环境做最大功,在等温可逆压缩过程中环境对系统做最小功。
【P24】:体积热力学能的变化,∆U=U2-U1=Q+W。
1、∆U=Qv等容. 条件:.没有非体积功的等容过程2、定压热Qp=H2一U1、∆H=Qp、焓的定义:H=U+PV恒压热=焓变条件:①Wf=o.没有非体积功的等压过程3、双原子分子Cpm=7R/2、Cv.m=5R/2、单原子分子Cvm=3R/2,Cpm=5R/2。