常见的碱(化学性质及通性)
- 格式:doc
- 大小:36.00 KB
- 文档页数:3



常见的碱及其性质专题一、定义1、碱:电离时生成的阴离子全部都是氢氧根离子的化合物叫做碱,碱常用通式M(OH)m 表示。
其电离方程式可记忆为:碱=金属离子+氢氧根离子;或写为:M(OH)m=M m++m OH-。
即碱可以理解为是由金属离子和氢氧根离子组成的。
由上式可知,在碱里跟一个金属离子结合的氢氧根离子的数目等于这种金属离子所带正电荷的数目。
在碱的组成里或碱在溶液中的阴离子只有OH-,这是判断是否碱的重要依据。
碱类中常见的有氢氧化钠(NaOH)、氢氧化钾(KOH)、氢氧化钡[Ba(OH)2],日常生活里会遇到的有熟石灰、氨水、氢氧化铝和一些生物碱(有机碱类),如烟碱(尼古丁)、金鸡纳碱(奎宁)等。
二、氢氧化钠和氢氧化钙注意:①晶体(固体)吸收空气里的水分,表面潮湿而逐步溶解的现象叫做潮解。
氢氧化钠、粗盐、氯化镁等物质都有潮解性,应注意密闭保存在干燥的地方。
②氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沾到皮肤上或洒在衣服上。
如果不慎将碱液沾到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
如果碱溶液流到桌上,可以立即往碱液里加适量的稀醋酸中和,然后用水冲洗桌面,再用抹布擦净。
如果只有少量碱液滴到桌上,可以立即用湿抹布擦净,再用水冲洗抹布。
三、碱的分类和命名1. 碱的分类根据碱在水里的溶解性,可以把常见的碱作如下分类:(1)可溶性碱:KOH、Ca(OH)2、NaOH、Ba(OH)2等;(2)难溶性碱:Cu(OH)2、Mg(OH)2、Fe(OH)3、Al(OH)3等。
2. 碱的命名根据碱的组成:M(OH)n一般称为“氢氧化某”。
当变价金属元素形成碱时,其:(1)高价态的碱称为“氢氧化某”,如Cu(OH)2氢氧化铜,Fe(OH)3 氢氧化铁;(2)低价态的碱称为“氢氧化亚某”,如CuOH 氢氧化亚铜,Fe(OH)2氢氧化亚铁注意:Ca(OH)2属微溶性碱,它在参加反应时作为“可溶”处理。
氨水(NH3·H2O)学名一水合氨,属于常见的一种弱碱,其电离方程式为:NH3·H2O=NH4++OH 。


常见的碱碱是一类重要的化合物。
生活中的碱也很常见,你在建筑工地和养殖场都能看到的熟石灰就是一种典型的碱;生活中的各种洗涤剂,如洗餐具的“白猫”洗洁精、厨房里的“油烟净”等,都含有碱。
本节我们就会知道碱有哪些重要的化学性质。
一、常见的碱常见的碱有氢氧化钠、氢氧化钙、氢氧化钾和氨水(32NH H O ⋅)等,它们的用途如下:(1)氢氧化钙俗名:熟石灰、消石灰。
制取方法:将石灰石放在石灰窑中煅烧,便得到生石灰,将生石灰与水反应,便得熟石灰。
有关方程式如下:32CaCO CaO CO ∆−−→↑+()22CaO H O Ca OH −−→+ 由于氧化钙能与水反应,利用这一性质氧化钙可作干燥剂。
氢氧化钙微溶于水,有腐蚀性,可用于禽舍、畜栏的消毒。
(2)氢氧化钠俗名:火碱、烧碱、苛性钠,氢氧化钠的性质实验如下:可见,氢氧化钠具有潮解性、水溶性和腐蚀性。
氢氧化钠和氧化钙都可以作干燥剂。
前者是吸水潮解,属于物理变化;后者是与水反应,属于化学变化。
=================================结论================================= ①氢氧化钠固体易吸收水分,故可用作干燥剂。
②氢氧化钠有强腐蚀性,使用时要特别小心。
如果不小心沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
二、碱的化学性质(1)碱与指示剂的作用能跟酸或碱的溶液作用而显示不同颜色的物质,叫酸碱指示剂,简称指示剂。
石蕊和酚酞是两种最常用的指示剂。
石蕊溶液本身为紫色,遇酸变成红色,遇碱溶液变成蓝色;酚酞溶液本身是无色,遇酸溶液不变色,遇碱溶液变成红色。
生活中许多有颜色的花、果实在遇到酸或碱的溶液时也有颜色的改变,如牵牛花、月季花、胡萝卜等,也可以作指示剂用。
由此得出碱的性质1:碱能使无色酚酞溶液变红色,使紫色石蕊溶液变蓝色。
在酸碱指示剂的使用中,需要注意如下几点:①能使无色酚酞变红的不一定是碱,如Na 2CO 3溶液与碱一样显碱性,可以使酚酞变红。



一、氢氧化钠(NaOH)1、氢氧化钠的物理性质。
(l)白色固体,能吸收空气中水分而潮解。
(2)极易溶于水,溶解时放出大量热。
(3)水溶液有涩味和滑腻感。
(4)有强烈的腐蚀性。
NaOH俗称苛性钠、火碱、烧碱的原因,氢氧化钠为何可做干燥剂?2、氢氧化钠的化学性质:(1)氢氧化钠与指示剂作用:能使紫色石蕊试液变,无色酚酞试液变(2)氢氧化钠与非金属氧化物,生成苛性钠暴露在空气中变质:NaOH + CO2-苛性钠吸收二氧化硫气体:NaOH + SO2-苛性钠吸收三氧化硫气体:NaOH + SO3-消石灰放在空气中变质:Ca(OH)2 + CO2-(3)氢氧化钠与酸发生中和反应,生成硫酸和烧碱反应:H2SO4 + NaOH -硝酸和烧碱反应:HNO3+ NaOH -(4)氢氧化钠与某些盐反应,生成氢氧化钠与硫酸铜:NaOH + CuSO4-氢氧化钠与氯化铁:NaOH + FeCl3-二、氢氧化钙[Ca(OH)2]氢氧化钙[Ca(OH)2]的形成:高温煅烧石灰石:CaCO3高温CaO + CO2↑CaO+H2O==Ca(OH)2 溶于水放出大量的热1、氢氧化钙的物理性质:白色固体(粉末)微溶于水(在水中溶解度随温度升高而减小)有腐蚀性,水溶液有滑腻感。
2、化学性质:(1):与指示剂作用:能使紫色石蕊试液变,无色酚酞试液变(2):与非金属氧化物反应,生成Ca(OH)2+CO2-Ca(OH)2 + SO2-(3):与酸发生中和反应,生成Ca(OH)2+2HNO3=Ca(NO3)2+2H2OCa(OH)2+ HCl-(4):与某些盐反应,生成注意:两种反应物必须是溶液,生成物必须要有一种是难溶的。
氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3-氢氧化钙的用途:三、碱的命名:一般叫氢氧化某,如果不同化合价的,低价的叫氢氧化亚某,如:Fe(OH)3叫氢氧化铁,Fe(OH)2叫氢氧化亚铁四、碱的通性:碱有相似化学性质原因:(1)碱溶液能使紫色石蕊试液变成色,无色酚酞试液变成色。

20种常见的碱化学式及其性质碱是一类与酸相对的物质,它们在水溶液中可以电离出氢氧根离子或者吸收氢离子。
碱有多种分类方法,例如按照电离能力、溶解性、用途等。
本文将介绍20种常见的碱化学式及其性质,以供参考。
强碱和弱碱按照电离能力,碱可以分为强碱和弱碱。
强碱是指在水溶液中完全或几乎完全电离的碱,它们的pH值接近14。
弱碱是指在水溶液中部分电离的碱,它们的pH值一般在7到14之间。
以下是一些常见的强碱和弱碱的化学式和pH值:碱化学式pH值氢氧化钠NaOH14氢氧化钾KOH14氢氧化钡Ba(OH)214氢氧化钙Ca(OH)212.4氨水NH3·H2O11.1碳酸氢钠NaHCO38.4碳酸钠Na2CO311.6可溶性碱和难溶性碱按照溶解性,碱可以分为可溶性碱和难溶性碱。
可溶性碱是指在水中能够溶解的碱,它们通常是一元或二元的氢氧化物。
难溶性碱是指在水中不能或很难溶解的碱,它们通常是多元的氢氧化物或含有过渡金属的氢氧化物。
以下是一些常见的可溶性碱和难溶性碱的化学式和溶解度:碱化学式溶解度(g/100g水)氢氧化钠NaOH111氢氧化钾KOH121氢氧化钡Ba(OH)2 3.9氢氧化钙Ca(OH)20.185氢氧化铝Al(OH)3不溶氢氧化铁(II)Fe(OH)2不溶氢氧化铁(III)Fe(OH)3不溶工业碱和食用碱按照用途,碱可以分为工业碱和食用碱。
工业碱是指用于工业生产或清洁等方面的碱,它们的纯度和杂质含量满足一般性工业使用,但对人体有危害。
食用碱是指用于食品加工或烹饪等方面的碱,它们的纯度和杂质含量符合食品安全标准,但过量摄入仍有不良影响。
以下是一些常见的工业碱和食用碱的化学式和用途:碱化学式用途工业纯碱Na2CO3制造玻璃、肥皂、洗涤剂等碱化学式用途工业烧碱NaOH制造纸张、人造纤维、染料等工业重碱NaHCO3制造泡沫塑料、消防器材等食用纯碱Na2CO3制作面食、腌制食品等食用小苏打NaHCO3制作发酵粉、饼干、蛋糕等其他常见的碱除了以上分类,还有一些其他常见的碱,它们有各自的性质和用途。

第3讲常见的碱一、常见的碱及其性质碱的含义:酸是指电离时生成的阴离子全部是OH 的化合物。
1、碱的通性(1)具有通性的原因由于碱溶于水生成(解离、电离)的阴离子全部是OH ,所以碱有相似的化学性质。
(2)碱的通性①使指示剂变色,使紫色石蕊试液变蓝色,使无色酚酞试液变红色。
②跟某些非金属氧化物反应,生成盐和水。
例:CO2+2NaOH Na 2CO3+H2O ;Ca(OH)2+CO2=CaCO3↓+H2O③跟酸反应,生成盐和水例:NaOH+HCl NaCl+H2O④跟某些盐反应,生成另一种碱和另一种盐。
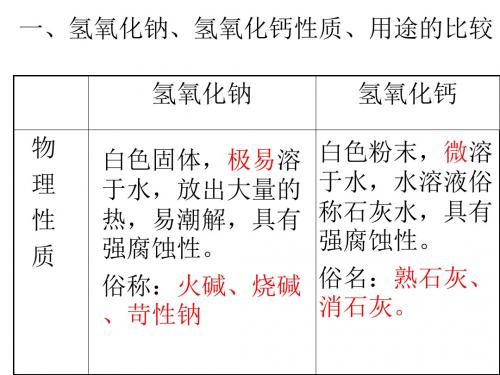
例:Ca(OH)2+Na2CO3CaCO3↓+2NaOH2、氢氧化钠与氢氧化钙物理性质的比较氢氧化钠(NaOH)氢氧化钙[Ca(OH)2]俗名苛性钠、火碱、烧碱熟石灰、消石灰颜色、状态白色块状固体白色粉末状固体溶解性易溶,且溶解时放出大量的热微溶腐蚀性强腐蚀性较强腐蚀性用途重要化工原料,应用于肥皂、石油、造纸、纺织、印染等工业;生活中可用来除油污重要的建筑材料,也是一种工业原料.如漂白粉,农业上用于改良酸性土壤3、氢氧化钠和氢氧化钙化学性质、用途、制取的比较氢氧化钠(NaOH)氢氧化钙[Ca(OH)2]电离方程式NaOH= Na++OH—Ca(OH)2= Ca2++2OH—与酸碱指示剂反应使紫色石蕊试液变蓝色,无色酚酞试液变红色与非金属氧化物反应CO2+2NaOH=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2O与酸反应NaOH+HCl=NaCl+H2O Ca(OH)2+2HNO3=Ca(NO3)2+2H2O与盐反应2NaOH+CuSO4=Cu(OH)2↓+Na2SO4Ca(OH)2+ Na2CO3= CaCO3↓+2NaOH 用途化工原料,用于肥皂,石油,造纸,纺建筑业,抹墙,农业上改良酸性土壤,织,印染等工业配置波尔多液,石硫合剂,工业上制取NaOH,漂白粉制取Na2CO3+Ca(OH)2= CaCO3↓+2NaOH CaO+H2O= Ca(OH)2拓展:(1)固体氢氧化钠暴露在空气中,易吸收空气中的水分,使固体表面逐渐溶解,这种现象叫潮解.因此可用氢氧化钠固体作某些气体的干燥剂,实验室也必须密封保存氢氧化钠固体.潮解是一个物理变化过程,没有新物质生成.(2)氢氧化钙可由生石灰与水反应制得:CaO+H2O Ca(OH)2,反应放出大量的热量,在工农业生产中有广泛的应用.(3)氢氧化钙与盐酸、硫酸、二氧化碳、氢氧化钠与二氧化碳反应的化学方程式分别为:Ca(OH)2+2HCl CaCl2+2H2OCa(OH)2+H2SO4CaSO4+2H2OCa(OH)2+CO2CaCO3↓+H2O(此方程式也是检验CO2的化学反应方程式)2NaOH+CO2Na2CO3+H2O二、酸与碱之间发生的反应(1)定义:酸跟碱起作用生成盐和水的反应,叫中和反应。

常见的碱和碱主要性质与用途(一)知识点1、碱的定义:电离时生成的阴离子的化合物,叫做碱。
2化学性质(碱具有通性的原因:碱的水溶液里都能含有OH-离子)A、与指示剂作用B、酸性氧化物+ 碱→盐+ 水NaOH + SO2 = Ca(OH)2 + CO2苛性钠暴露在空气中变质苛性钠吸收三氧化硫气体消石灰吸收二氧化硫C、酸+ 碱→盐+ 水2NaOH + H2SO4 = Ca(OH)2 + 2HCl =盐酸和烧碱起反应:盐酸和氢氧化钾反应:盐酸和氢氧化铜反应:盐酸和氢氧化钙反应:盐酸和氢氧化铁反应:氢氧化铝药物治疗胃酸过多:硫酸和烧碱反应:硫酸和氢氧化钾反应:硫酸和氢氧化铜:硫酸和氢氧化铁:硝酸和烧碱反应:氨水和硫酸反应:D、某些盐+ 碱→新盐+ 新碱FeCl3 + 3NaOH = CuSO4 + 2NaOH =Ca(OH)2 + Na2CO3 =CuSO4 + Ba(OH)2 =氢氧化钠与硫酸铜:氢氧化钠与氯化铁:氢氧化钠与氯化镁:氢氧化钠与氯化铜:氢氧化钙与碳酸钠:补充:1可溶性碱对应的碱性氧化物溶于水生成碱:氧化钠和水氧化钾和水氧化钡和水氧化钙和水2不溶性碱对应的碱加热会分解例如:Cu(OH)2△CuO+ H2O氢氧化镁氢氧化锌氢氧化铝氢氧化铁5制碱方法:(1)可溶性碱①碱性氧化物溶于水CaO+H2O=②碱和盐反应Ca(OH)2+ Na2CO3=(2)不溶性碱先制可溶性盐,再和可溶性碱反应来制取2Cu+O2△CuO+2HCl=CuCl2+2NaOH=(3)制取NaOH用:Ca(OH)2+ Na2CO3—制取Ca(OH)2用:CaO+H2O—6中和反应定义:。
氧化镁和硫酸反应生成了盐和水,这个反应是中和反应吗?。
中和反应的应用1 农业上用熟石灰降低土壤的酸性2 石油工业上用烧碱中和过量的硫酸3 医学上用氢氧化铝中和过多的胃酸4 中和反应的实质。

3. 碱+酸→盐+水(复分解反应、中和反应)在碱的通性中,弱碱只有该性质。
4. 碱+盐→新碱+新盐(复分解反应)a) 反应发生的条件:①反应物能溶于水(包括氢氧化钙,不包括其他微溶于水的物质);②新碱是氨水;③若新碱不是氨水,新碱和新盐中至少有一个沉淀。
b) 铵盐一定能与四大强碱反应。
c) 新碱是沉淀:蓝色沉淀– 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓红褐色沉淀– 3NaOH+FeCl3=3NaCl+Fe(OH)3↓白色沉淀– 2NaOH+MgSO4=Na2SO4+Mg(OH)2↓d) 新盐是沉淀:Ba(OH)2+Na2SO4=BaSO4↓+ 2NaOHCa(OH)2+Na2CO3=CaCO3↓+2NaOHe) 蓝白沉淀:Ba(OH)2+CuSO4=BaSO4↓+ Cu(OH)2↓f) 红白沉淀:3Ba(OH)2+Fe2(SO4)3=3BaSO4↓+ 2Fe(OH)3↓g) 波尔多液(注:波尔多液不是溶液):Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓四、氢氧化钠和氢氧化钙变质1. 氢氧化钠变质氢氧化钠变质是因为与空气中的二氧化碳反应生成碳酸钠。
证明方法:a) 取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:NaOH+HCl=NaCl+H2O 和Na2CO3+2HCl=2NaCl+H2O+CO2↑b) 取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓c) 取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:Na2CO3+CaCl2=2NaCl+CaCO3↓或Na2CO3+Ca(NO3)2=2NaNO3+CaCO3↓2. 氢氧化钙变质氢氧化钙变质是因为与空气中的二氧化碳反应生成碳酸钙。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:Ca(OH)2+2HCl=CaCl2+2H2OCaCO3+2HCl=CaCl2+H2O+CO2↑3. 氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。



常见的碱化学性质及通性Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】常见的碱(化学性质及通性)一、碱的定义和分类四大强碱:碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2二、常见的碱氢氧化钠(烧碱、火碱、苛性钠)化学式NaOH工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓状态白色块状固体腐蚀性强腐蚀性特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)化学式Ca(OH)2工业制法CaCO3CaO+CO2↑,CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:①吸水性;②能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。


常见的碱◆常见的碱◆碱的化学性质◆碱的用途◆碱的通性知识点一常见的碱常用的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
1. 氢氧化钠(1)氢氧化钠的物理性质氢氧化钠常温下是一种白色晶体,易溶于水,溶解时放出大量的热。
(2)氢氧化钠的俗称:火碱、烧碱、苛性钠。
(3)氢氧化钠的腐蚀性氢氧化钠具有强烈的腐蚀性。
较浓的氢氧化钠溶液溅到皮肤上如同火烧,会腐蚀表皮,造成烧伤。
如果不慎沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
图1被氢氧化钠腐蚀的鸡爪(4)氢氧化钠的潮解氢氧化钠是一种极常用的碱,是化学实验室的必备药品之一。
氢氧化钠在空气中易吸收水蒸气发生潮解,所以它也可以和浓硫酸一样用作干燥剂。
氢氧化钠必须密封保存,长期露置会吸收空气中的水分,给使用造成不便。
(5)氢氧化钠的用途氢氧化钠是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业中。
氢氧化钠能与油脂反应,在生活中可用来去除油污,如炉具清洁剂中就含有氢氧化钠。
图2氢氧化钠溶液和固体1. “苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有()A.1种B.2种C.3种D.4种【答案】B。
【解析】苛性钠、火碱和烧碱都是氢氧化钠的俗称;纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。
2.下列有关物质的性质与用途具有对应关系的是A. 氮气难溶于水,可用作保护气B. 铝合金能导电,可用于制造门窗C. 氢氧化钠具有腐蚀性,可用作干燥剂D. 一氧化碳具有还原性,可用于炼铁【答案】D【解析】解:氮气的化学性质比较稳定,所以可用作保护气,对应关系错误;B.铝合金硬度大、质轻,抗腐蚀性强,所以可用于制造门窗,对应关系错误;C.氢氧化钠固体易潮解,所以可用作干燥剂,对应关系错误;D.一氧化碳具有还原性,所以可用于炼铁,对应关系正确。
故选:。
3.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡.经过一段时间后,下列有关叙述正确的是A. 指针偏左,食盐溶液一定变稀,烧碱潮解B. 指针偏右,食盐溶液一定饱和,烧碱潮解C. 指针偏左,食盐溶液一定变浓,烧碱潮解D. 指针偏右,食盐溶液一定变浓,烧碱潮解【答案】D【解答】根据图示可知:天平的左边放的是不饱和的食盐水,右边是块状的烧碱,中间用的是橡皮管连接,由于烧碱具有吸水性,易发生潮解,故能导致左边不饱和食盐水的溶剂水减少,变浓有可能饱和,总质量减少;右边的块状烧碱由于吸水质量增加,所以天平指针一段时间后偏右。

例题分析1.下列有关物质的名称,俗名、化学式中,三者指同一物质的是()A.氧化钠,消石灰、NaClO B.氢氧化钙,生石灰、CaOC.碳酸钙、石灰石,CaO D.氢氧化钠,火碱、NaOH【答案】D2.下列关于NaOH和Ca(OH)2的用途中错误的是()A.用Ca(OH)2制波尔多液B.用Ca(OH)2改良酸性土壤C.用NaOH溶液检验CO2D.用NaOH固体干燥某些气体【答案】C3.下列物质的用途,利用其化学性质的是()A.用活性炭吸附冰箱里的异味B.用金属铜制导线C.用熟石灰改良酸性土壤D.用浓硫酸做干燥剂【答案】C4.气体X可用如图装置干燥,则气体X可能是()A.二氧化碳B.氧气C.氯化氢D.二氧化硫【答案】B课堂练习1.下列各组物质中,俗名,化学名称和化学式表示的是同一种物质的是()A.烧碱、氢氧化钠、Na2OB.纯碱、氢氧化钠、NaHOC.小苏打、碳酸氢钠、NaHCO3D.熟石灰、氧化钙、CaO【答案】C2.下列物质敞口放置在空气中质量会增加的是()①浓硫酸②浓盐酸③纯碱④烧碱⑤生石灰A.①②③④⑤B.①③④⑤C.①④⑤D.①④【答案】C3.物质性质决定它的用途,还决定了它的保存方法。
固体NaOH具有以下性质:①白色片状固体,②有腐蚀性,③易吸收水分而潮解,④能与空气中的二氧化碳反应。
实验室中必须将它密封保存的主要原因是()A.①②B.②③C.③④D.①③【答案】C4.下列有关氢氧化钠的说法,错误的是()A.氢氧化钠俗称烧碱B.氢氧化钠有强烈的腐蚀性C.氢氧化钠固体可用于干燥二氧化碳气体D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等【答案】C5.我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证。
航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是()A.与二氧化碳反应B.与盐酸反应C.与氧化铁反应D.与稀硫酸溶液反应【答案】C6.如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。