坏死性小肠结肠炎动物模型具体方法及步骤
- 格式:docx
- 大小:51.28 KB
- 文档页数:3

结肠炎动物模型具体步骤及方法预览说明:预览图片所展示的格式为文档的源格式展示,下载源文件没有水印,内容可编辑和复制结肠炎动物模型具体步骤及方法原型物种人来源三硝基苯磺酸钠(TNBS)导致的结肠炎模式动物品系SPF级SD大鼠,健康,6~8W,雄性,体重为180g-200g。
实验分组实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组。
实验周期4-6 weeks建模方法模型制作方法:动物造模当日计为实验第1天,各组动物造模前禁食不禁水24 h,乙醚吸入麻醉,将一直径2.0 mm、长约12 cm的塑胶管由肛门轻缓插入大鼠体内深约8 cm,缓慢注入一定浓度的TNBS的乙醇溶液,1 min之内完成。
灌药完毕后,缓慢拔出塑胶管,用手捏住肛门,提起大鼠尾部,持续倒置3min,避免造模试剂流出,使造模剂充分渗入大鼠肠腔内。
对照组动物使用等体积的生理盐水,按上述同样操作进行灌肠。
各组动物均正常饲养。
TNBS的乙醇溶液(将体积分数为5%的TNBS水溶液与无水乙醇以体积2:1混合)现配现用。
应用用于结肠炎药物的研发和机理的研究1. 一般情况观察及体重记录一般观察:观察各组动物的情况,若出现意外症状,记录情况并及时反馈;记录可能出现的死亡率。
体重:从给药前一天开始,每三天称量并记录各组动物体重,直至给药结束,绘制体重变化曲线。
实验过程中体重共记录10次体重统计、变化曲线作图。
2. 肠组织取材及大体评分:各组动物安乐死后,解剖时截取自肛门向上的整段结肠组织测量结肠长度进行宏观评价:各个结肠组织带标尺拍照,记录原始的大体形态,依照评分标准进行评分。
结肠组织大体评分标准如下:0分无损伤1分充血但没有溃疡2分充血而且肠壁变厚但没有溃疡3分有一处小溃疡,最长径约0-1cm4分溃疡较大,最长径约1-2cm5分溃疡较大,最长径>2cm对应以上评分标准,记录每份结肠组织的具体评分。
评分标准参考文献:Wallace JL, Keenan CM. An orally active inhibitro of leukotriene synthesis accelerates healing in a rat model of colitis. Am J Physiol,1990 258:G527-G5343.3 结肠组织病理染色:组织做以下处理:每个结肠均分成3段,每个动物取材的位置要尽量一致(不管剪切位置是否有病理损伤尽量保持一致)。

摘要:目的研究坏死性小肠结肠炎(NEC )大鼠模型的简易制作方法。
方法3日龄SD 大鼠30只,雌雄不限,随机分2组(每组15只),即正常对照组与NEC 模型组,采用肠内配方喂养、低氧高氧暴露和冷刺激的综合应激方法造模,成功后取肠管组织,HE 染色光镜下观察并行Shiou 评分,Elisa 法检测炎性因子(TNF-α、IL-1β和IL-6)的水平。
结果NEC 模型组实验中死亡1只,对照组无死亡;与正常对照组相比,NEC 模型组HE 染色光镜下可见炎症反应明显,病理学检测Shiou 评分明显增高(P <0.01);Elisa 法检测炎性因子(TNF-α、IL-1β和IL-6)含量明显升高,差异有统计学意义(P <0.01)。
结论肠内配方喂养、低氧高氧暴露和冷刺激的综合应激方法能成功建立NEC 大鼠模型,且建模可重复性好,成功率高。
关键词:坏死性小肠结肠炎;Shiou 评分;炎性因子;大鼠中图分类号:R725.7文献标识码:A文章编号:1671-3699(2018)03-0083-04DOI :10.3969/j.issn.1671-3699.2018.03.018新生大鼠坏死性小肠结肠炎模型的建立与评价李小兵1,梁淑霞1,赖盼建1,徐洁1,包云光1,丁明星2,方远书3(1.金华市中心医院,浙江金华321000;2.金华职业技术学院,浙江金华321007;3.金华市实验动物中心,浙江金华321000)坏死性小肠结肠炎(necrotizing enterocolitis ,NEC )为新生儿常见胃肠道急诊,与NEC 相关的病死率高达20%~30%[1],常见诱因如早产、肠内喂养和感染等目前已确定,但其发病机制的不确定,临床仍然缺乏明确而有效的治疗策略[2],还缺乏早期手术干预控制病程的足够证据,NEC 早期监测与预防极为关键[3]。
因而需要建立NEC 的可靠动物模型进行深入研究,而目前常见的建模方法均存在一定的不足。



常见新生儿疾病动物模型的特点与比较荣箫周伟近年来,随着产科和新生儿重症监护治疗技术的发展,我国早产儿、低出生体重儿、多胎儿的出生率有明显增高趋势,新生儿疾病一直是儿科疾病中研究的热点。
建立合适的动物模型是研究新生儿疾病的关键,可以避免在人身上进行实验所带来的风险,本文就目前常见新生儿疾病的各种动物模型的特点作一综合介绍和比较。
一、实验动物的选择:迄今为止,用于建立新生儿疾病动物模型和进行各种相关研究的动物主要包括大鼠、小鼠、豚鼠、新西兰白兔、绵羊、狗、猪和灵长类动物。
大鼠、小鼠、豚鼠、绵羊和新西兰白兔是常规的实验动物,其中啮齿类动物由于其遗传背景清晰,容易获得,操作简单,重复性好,价格经济,使用最为广泛,可用于发病机制、药理学及神经行为学等的研究。
实验动物的选择通常以实验目的和动物各自的特点来决定。
若实验中需要每天抽取子代血液作为标本,就应选择体形大一些的动物如绵羊,以使用留置导管,为实验提供方便;若进行以形态学和分子生物学检测技术为基础的实验,则适宜选择体形较小的动物;当需要设窝内对照时,新西兰白兔则是最佳的考虑对象,因为子兔在孕兔子宫内有着各自的羊膜腔;选用灵长类动物如恒河猴或猕猴作研究对象的价值在于:此类动物有与人类极其相似的生物学特性和解剖结构;猪的解剖和生理学与人类较为相似,也成为近年的研究热点。
此外,为确保实验结果的准确性和可重复性,应尽量选用与研究内容相匹配的经遗传学、微生物学、环境及营养控制的标准化实验动物,才能排除微生物的干扰和潜在疾病对实验结构的影响,排除遗传污染造成的个体差异。
二、常见的新生儿疾病动物模型(一)胎儿生长受限(fetal growth restriction , FGR)模型1.子宫血管结扎法:早期的做法是于孕晚期完全结扎妊娠动物的双侧子宫动脉以减少胎儿营养素和氧的供给[1],但这种做法在短时间内完全阻断了子宫动脉的血流,死胎率高,建模成功率相对较低。
目前常用的做法是部分结扎子宫动脉[2]或部分结扎子宫动脉和子宫静脉[3]。

脂多糖联合人工喂养诱导新生大鼠坏死性小肠结肠炎模型的建立与评价李美雪;周伟;吕回;陶莉;黄龙光;袁伟明【期刊名称】《发育医学电子杂志》【年(卷),期】2014(000)001【摘要】目的:探讨脂多糖(内毒素,LPS)联合人工喂养诱导新生大鼠坏死性小肠结肠炎(NEC)模型的方法并评价其效果。
方法出生当日 SD 新生大鼠,按不同的造模方式随机分为9组(每组8只):A 组大鼠人工喂养;B1、B2、B3、B4、B5、B6组为人工喂养+LPS 灌胃,LPS 的剂量分别为5、10、15、20、30、40mg/kg,以筛选 LPS 诱导新生大鼠 NEC 模型的最佳剂量;C 组大鼠采取鼠乳喂养+LPS(30 mg/kg)灌胃;D 组大鼠为鼠乳喂养,作为正常对照组。
每日定时称量体重。
3天后禁食24小时取回肠末端组织 HE 染色,光镜下观察肠道组织病理损伤情况,并进行病理评分,评分≥2分确定为NEC。
按B5组造模条件,重复两次,每次8只,分别为 B5a、B5b 组。
结果 A、B4、B5、B6组新生大鼠均出现不同程度的活动减少,倦怠,进而可见腹胀及粪便颜色性状发生改变。
实验结束 A、B 组体重不增或下降,C、D 组体重增加,A、B 组体重分别与 D 组比较,差异均有显著性(P <0.05)。
各组病理评分分别为 A 组:1.78±0.52,B1组:1.76±0.32,B2组:1.83±0.1,B3组:1.87±0.33,B4组:2.16±0.11,B5组:3.34±0.37,B6组:3.78±0.51,C 组:0.52±0.42,D 组:0.3±0.48。
B5a、B5b 组评分分别为3.3±0.17、3.35±0.44。
B5、B6模型组分别与对照组比较,差异均有显著性(P<0.05);模型组内 B5、B6组分别与 B1、B2、B3、B4组比较,差异均有显著性(P<0.05);B5、B6组分别与 A 组比较,差异均有显著性(P<0.05)。

N-乙酰半胱氨酸对新生鼠坏死性小肠结肠炎保护作用蒋月娟;陈霞【摘要】目的探讨N-乙酰半胱氨酸(NAC)对坏死性小肠结肠炎(NEC)SD新生大鼠模型肠道损伤的保护作用.方法3日龄SD大鼠40只随机分为4组:NEC模型组、NAC对照组、生理盐水对照组、NEC模型+NAC组,每组10只.通过缺氧复氧冷刺激5d制备NEC模型,此后,除NEC模型组外,其余3组给予NAC(100 mg欣)或生理盐水(5 mJ/次)灌胃,1次/d,共5d.各组在实验第5、10 d分别处死5只大鼠,解剖回盲部近端肠管行病理学检查,静脉血测定血清丙二醛(MDA)、谷胱甘肽-过氧化物酶(GSH-PX)和超氧化物酶(SOD)水平.结果 NEC模型组实验中共死亡2只,其余组无死亡.NEC模型+NAC组和NEC模型组第10 d肠道组织病理评分均高于生理盐水对照组和NAC对照组(P<0.05),NEC模型+NAC组评分低于NEC模型组(P<0.05).在实验后第5d及第10 d,NEC模型组血清抗氧化活显著低于NAC对照组、生理盐水对照组(P<0.05),也显著低于NEC模型+NAC组(P<0.05),提示NAC可明显提高血清抗氧化活性(P<0.05).结论 NAC可以减轻NEC大鼠模型肠道组织病理损伤,提高机体抗氧化水平,具有良好的肠道保护作用.【期刊名称】《西南国防医药》【年(卷),期】2016(026)012【总页数】3页(P1416-1418)【关键词】小肠结肠炎;坏死性;N-乙酰半胱氨酸;抗氧化;大鼠【作者】蒋月娟;陈霞【作者单位】643000四川自贡,自贡市第二人民医院儿科;解放军324医院儿科【正文语种】中文【中图分类】R516.1坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿阶段严重的胃肠道疾病,虽然近年来新生儿救治技术不断提高,但该病死亡率仍居高不下,因此,寻求对NEC安全、有效的干预措施,已成为全世界新生儿科医师研究的热点之一[1]。
结肠炎(UC)模型的建立及药物的治疗测定DSS是一种有蔗糖合成的,有抗止血和抗凝血作用的肝素样硫酸多醣体。
BALB/c鼠的遗传背景为近交系,由亲兄弟姐妹遗传繁殖,因而它们之间的个体差异就小,遗传基因更纯,整体素质更好。
采用在蒸馏水中加入DSS制成5%DSS 溶液给予小鼠自由饮用造模。
一、确定DSS的最适浓度实验材料:BALB/c小鼠6只,全是雌性。
8-10周左右,体重约为25-30g.实验试剂:葡聚糖硫酸钠(DSS)(MW=40000),配制成4%的浓度溶液。
实验仪器:电子天平,生物显微镜,微量移液器,枪头。
实验方法:将小鼠随机分为3组,每组2只。
分别为正常对照组,4%DSS浓度组。
二.实验步骤1.将6只小鼠正常喂养5天。
2. 5天以后,正常对照组继续正常饲养,但4%DSS浓度组分别喂养配置好的4% 溶液10ml。
(一日/一次,连续7天,7天内每天同一时间测量小鼠体重,粪便,便血情况,并进行活动指数评分。
)建模期间控制小鼠的食量。
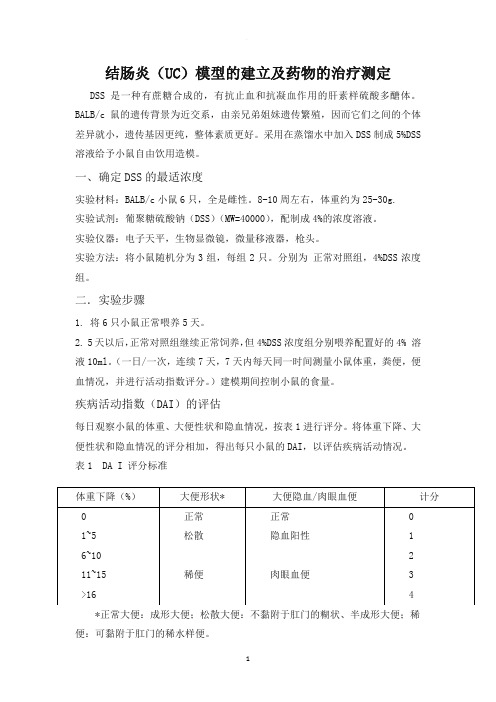
疾病活动指数(DAI)的评估每日观察小鼠的体重、大便性状和隐血情况,按表1进行评分。
将体重下降、大便性状和隐血情况的评分相加,得出每只小鼠的DAI,以评估疾病活动情况。
表1 DA I 评分标准*正常大便:成形大便;松散大便:不黏附于肛门的糊状、半成形大便;稀便:可黏附于肛门的稀水样便。
硫酸甲氨基酚法进行大便隐血试验(试剂:①10g/l硫酸甲氨基酚乙酸溶液:称取硫酸甲氨基酚1g,溶于40ml 蒸馏水中,加冰乙酸30ml溶解,蒸馏水加至100ml混匀。
放入棕色瓶中避光保存,如有变色则应重新配制。
②3% 过氧化氢溶液。
方法:取少许粪便涂于玻片中央,滴加10g/l硫酸甲氨基酚乙酸溶液3滴,及3% 过氧化氢溶液3滴混匀,立即观察结果。
阴性(-):3分钟后不出现玫瑰红色或樱红色;(+):30~60秒钟内显玫瑰红色或樱红色;强阳性(++):立即显玫瑰红色或樱红色;最强阳性(+++):立即显深玫瑰红色或深樱红色;隐血试验注意事项:1、3%过氧化氢易失效,用前滴加在血膜上,有气泡产生方可应用。

新生鼠坏死性小肠结肠炎动物模型建立方法改进作者:刘斌阎静江李晓霞来源:《中国现代医生》2015年第35期[摘要] 目的使用环境模拟实验装置建立一个更为标准及简便易行的新生儿坏死性小肠结肠炎动物模型造模方法。
方法 75只新生24 h昆明小鼠随机分为5组,A1、A2和A3组采用人工喂养+缺氧复氧冷刺激+LPS灌胃;B组单纯人工喂养,C组为正常对照组。
饲喂72 h后处死小鼠,进行肠道组织病理学评分。
结果处理组新生鼠肠道组织与单纯人工喂养组及正常对照组相比差异均有统计学意义(P[关键词] 新生儿坏死性小肠结肠炎;肠道损伤;动物模型;新方法[中图分类号] R725.7 [文献标识码] A [文章编号] 1673-9701(2015)35-0022-04[Abstract] Objective To establish a standard and simple method of the neonatal necrotizing enterocolitis(NEC) animal model by the environment simulation equipment. Methods Seventy-five newborn mice at age of 24 hours were randomLy divided into 5 groups. Group A1 group, A2 group and A3 group were given artificial feeding, discontinuities cold/hypoxia exposure and LPS gavage. Group B was only given artificial feeding. Group C was a control group. Mice were sacrificed after being fed for 84 hours. Intestinal histopathology was scored. Results There was statistically significant between group A1, group B and group C (P[Key words] Neonatal necrotizing enterocolitis; Injury of intestine; Animal model; New method坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是一种具有潜在致死性的新生儿胃肠道急症,由于缺乏有效预防治疗措施,患儿死亡率较高,对新生儿存活率有着严重影响,从而受到临床医生和研究人员的高度重视。

小鼠结肠炎造模流程一、模型简介硫酸葡聚糖(dextran sulphate sodium, DSS)属于葡聚糖的聚阴离子衍生物,由葡聚糖和氯磺酸的酯化反应形成。
其中含硫量约为17%,相当于葡聚糖分子的每个葡萄糖残糖中平均含1.9个硫酸基团。
白色或淡黄色粉末。
易溶于水,微溶于乙醇。
10%水溶液为无色或淡黄色澄清溶液。
如需灭菌,防止降解,应配成缓冲体系(如碳酸氢钠)。
自1985年首次报道采用葡聚糖硫酸钠制备出仓鼠溃疡性结肠炎模型以来,已有大量研究证明DSS结肠炎模型与人类溃疡性结肠炎相似。
DSS结肠炎模型的组织学特点、临床表现、发病部位和细胞因子情况都与人类溃疡性结肠炎(ulcerative colitis, UC)极为相似。
该模型的造模条件和操作方法简单,造价便宜,重复性好,便于掌握和推广;可根据实验目的调整DSS浓度和给药时间,建立急性、慢性和急慢性交替性模型。
二、建立急性、慢性结肠炎模型具体步骤通常用纯水制成DSS溶液给予动物自由饮用造模。
有时配合偶氮甲烷(AOM)联合造模。
采用不同的DSS浓度(W/V)、给药时间和给药频率,可制成急性和慢性俩种结肠炎模型(IBD)。
急性结肠炎模型常采用较高浓度DSS溶液和相对短的给药时间建立。
如:3%-5%DSS溶液自由饮用4-7天。
慢性结肠炎模型则可采用低浓度DSS,长时间给药建立。
如给予大鼠1%DSS溶液自由饮用120天。
2.1、DSS溶液制备(2% DSS溶液):溶解10g DSS于500mL无菌水中(或者无菌的饮用水),使用前保存于4℃冰箱,建议现配现用。
2.2、结肠炎建模(DSS,Mw:36000-50000 Da)2.3急性结肠炎①第一天称重和标记小鼠②加DSS溶液灌满小鼠笼内的饮水槽,以5mL DSS溶液/小鼠/天加量,对照小鼠加等体积不含DSS的饮用水③第3天清空笼内剩余的DSS饮用水,每两天重新装满DSS溶液④第8天清空笼内剩余的DSS饮用水,换上不含DSS的无菌水2.4慢性结肠炎①按照急性结肠炎造模步骤进行到第3步②第8天清空笼子内剩余的DSS溶液,换上不含DSS的无菌水持续到14天③第22-26天重复急性结肠炎造模步骤中的第2-5步④第29天清空笼子内剩余的DSS溶液,换上不含DSS的无菌水持续到14天⑤第43-47天重复急性结肠炎建模步骤中的第2-5步⑥第50天用无菌水换掉笼内剩余的DSS溶液。

坏死性小肠结肠炎简易高效动物模型的建立陈康;林振浪;林锦【期刊名称】《全科医学临床与教育》【年(卷),期】2012(10)5【摘要】目的研究坏死性小肠结肠炎(NEC)动物模型的简易制作方法.方法新生大鼠称重后随机分为三组,分别予0.9%氯化钠注射液(NS)、150 mmol/L乙酸(AA)、300 mmol/L AA灌肠,观察其症状表现,24 h后称重,然后断颈处死;取出近端结肠用以组织病理学评分,并留取血清标本做髓过氧化物酶(MPO)活性检测和白细胞介素6(IL-6)浓度检测.结果300 mmol/L AA组与NS组比较,MPO活性、IL-6浓度、组织病理学评分各方面明显增加,差异均有统计学意义(t分别=3.56、6.34,x2=30.50,P均<0.05);试验前后24 h体重增长明显减少,差异有统计学意义(t=3.75,P<0.05).150 mmol/L AA组与NS组比较,试验前后24 h体重变化、MPO活性、IL-6浓度、组织病理学评分各方面,差异均无统计学意义(t分别=1.41、0.94、2.16,x2=5.30,P均>0.05).结论这种简单易行的方法能成功地建立NEC动物模型,且具有可重复性好、成功率高、建模周期短等特点,可应用于NEC的相关研究.【总页数】5页(P490-492,499,封2)【作者】陈康;林振浪;林锦【作者单位】310016浙江杭州,浙江大学医学院附属邵逸夫医院儿科;温州医学院附属育英儿童医院新生儿科;美国纽约西奈山医学中心【正文语种】中文【相关文献】1.简易的豚鼠皮肤单纯疱疹动物模型的建立及应用 [J], 李向群;毛琳;肖红;侯伟;文莉;杨占秋2.坏死性小肠结肠炎晚发和长病程动物模型的建立 [J], 王玲玲;金芳;温博贤;冼其;熊慧;林楚琴;黄堃莹;江观银;黄艳3.一种简易异种肾移植动物模型的建立 [J], 郭泽雄;苏泽轩;钟玲;丁泓文4.新生鼠坏死性小肠结肠炎动物模型建立方法改进 [J], 刘斌;阎静江;李晓霞5.新生儿坏死性小肠结肠炎动物模型建立方法改进与比较 [J], 李金纯;韦红;贾盛华;魏小娣因版权原因,仅展示原文概要,查看原文内容请购买。

溃疡性结肠炎动物模型建立、评价溃疡性结肠炎( Ulcerative Colitis) 又称非特异性溃疡性结肠炎,是一种病因不明的大肠黏膜的慢性炎症和溃疡性病变。
主要临床表现有腹痛,腹泻、粘液脓血便、里急后重等。
病程长,常反复发作,迁延不愈,发作期与缓解期交替,较难治愈。
病变主要累及直肠和乙状结肠,严重者可侵犯全部结肠甚至回肠末端,其病理特点是结肠黏膜广泛溃疡形成。
溃疡性结肠炎发病可能与感染、遗传及免疫等因素有关。
[1]建立理想的动物模型对于阐明该病的病因、病变发展规律以及有效的防治有重要意义。
利用动物模型实验,可以免去对人体的伤害;可以严格控制条件,排除各种干扰;提高复制的成功率和缩短病程,便于实验的多次重复;便于实验样品的全面采集。
动物模型固然有其优越性,可是毕竟这是一种带有模拟性质的间接实验,得出的结论具有局限性。
关键词:溃疡性结肠炎;动物模型;病理动物模型具有UC动物模型的制备方法, 大致可分为四类:免疫诱发法,化学损伤法,复合法,中医证型造模法。
1.免疫造模法张晓峰等[2]取家免或人新鲜结肠黏膜组织,加入完全弗氏佐剂,制成抗原乳剂,首次于大鼠足跖注射抗原乳剂0.4ml(含抗原4mg),第10、17、24、31天时分别于大鼠不同部位皮下注射抗原乳剂0.8ml(含抗原8mg),第31天不加佐剂灌肠。
予抗原4mg。
上述处理结束后第2天, 大鼠出现黏液血便, 精神萎靡。
病变黏膜可见炎症、溃疡形成, 促炎细胞因子IL- l、IL- 6、TNF及其mRNA 表达增强, 免疫球蛋白也发生与人UC相似的变化[3]。
该模型的特点是病变持续时间较长,与人UC的免疫发病机制和病理变化均较接近, 但造模过程较繁琐, 周期较长,掌握困难,重复性不理想。
黄永年等[4]取牛结肠黏膜蛋白与完全弗氏佐剂( 1: 1)制成完全抗原,大鼠首次足跖内注射抗原4mg/只,于第10、17、24、31天分别于足跖、背部、腹股沟、腹腔内注射抗原6mg/只,最后1次注射不加佐,至血清抗结肠抗体达到作用有效量、第35天用20g/L的甲醛溶液1.5 ml灌肠, 留置1用生理盐水洗净后排去,再用抗原液( 4 g /L,不加佐剂)2 ml灌肠,置2 h, 3d 后处死大鼠, 取其结肠标本,病理检查有充血、水肿、炎细胞浸润和溃疡形成等。



坏死性小肠结肠炎晚发和长病程动物模型的建立王玲玲;金芳;温博贤;冼其;熊慧;林楚琴;黄堃莹;江观银;黄艳【摘要】目的建立坏死性小肠结肠炎(NEC)晚发和长病程动物模型,为NEC相关研究提供新的实验平台.方法 10日龄SD大鼠随机分为Dith/FFLAS组(n=47)、FFLAS组(n=32)、Dith组(n=32)、Control组(n=32).Dith/FFLAS组给予腹腔注射双硫腙(Dith),结合人工喂养和缺氧、内毒素LPS刺激(FFLAS)进行诱导.每天观察临床表现和体质量变化,于24 h、72 h、7 d、15 d抽样进行肠组织学评分,分析各时点的NEC患病率和病损程度,评估最佳成模时间和病变迁延情况.结果Dith/FFLAS组48~72 h普遍出现腹胀、腹泻等NEC症状,个别出现血便;72 h和7 d患病率最高,分别为87.50%(7/8)和71.43%(5/7),显著高于FFLAS组(P<0.05).4组肠组织评分分别为:24h(1.00±0.53),(0.50±0.53),(0.50±0.53),(0.25±0.46),72h(2.38±0.92),(1.13±0.64),(0.25±0.46),(0.38±0.52),7d(2.00±0.82),(0.75±0.46),(0.13±0.35),(0.25±0.46),15d(1.00±0.63),(0.38±0.52),(0.25±0.46),(0.13±0.35),差异均有统计学意义(F24h=3.00,F72h=17.05,F7d=14.09,F15d=4.08,P值均<0.05).各时点均以Dith/FFLAS组评分最高,不仅与Control组差异有统计学意义(P<0.05);而且在72 h、7 d、15 d时点都显著高于FFLAS组(P<0.05)和Dith组(P<0.05).Dith/FFLAS 组不同时点病变程度差异有统计学意义(F=6.60,P<0.01);72 h和7 d损伤程度显著高于24 h和15 d(P<0.05).结论 Dith/FFLAS法能在10日龄大鼠成功建立晚发和长病程NEC模型,72 h成模率87.50%,病变至少迁延至第7天,15天仍未完全修复.【期刊名称】《当代医学》【年(卷),期】2018(024)008【总页数】5页(P1-5)【关键词】坏死性小肠结肠炎;人类疾病动物模型;双硫腙【作者】王玲玲;金芳;温博贤;冼其;熊慧;林楚琴;黄堃莹;江观银;黄艳【作者单位】中山大学附属第六医院儿科,广东广州 510655;中山大学附属第六医院儿科,广东广州 510655;中山大学附属第六医院儿科,广东广州 510655;广州市红十字会医院病理科,广东广州 510220;中山大学附属第六医院儿科,广东广州510655;中山大学附属第六医院儿科,广东广州 510655;中山大学附属第六医院儿科,广东广州 510655;中山大学附属第六医院儿科,广东广州 510655;中山大学附属第六医院儿科,广东广州 510655【正文语种】中文坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是早产儿致死、致残的重要疾病,发病机制尚未完全阐明,临床缺乏确切有效的防治手段[1]。


急性坏死性小肠结肠炎急性坏死性小肠结肠炎是一种原因尚未完全明确的肠管急性节段性炎症病变,起病急,病情发展快,主要累及空肠和回肠,以腹痛、便血、腹泻、腹胀、呕吐、发热及中毒症状为主要表现。
本病病情发展快,重症可出现败血症和中毒性休克,严重威胁患者生命。
由于在手术或尸检中可以见到不同阶段的病变,发现有充血、水肿、出血、坏死等不同的病理改变,故又被称为急性节段性肠炎、急性坏死性肠炎、节段性出血性坏死性肠炎、急性出血坏死性肠炎、坏死性肠炎等。
一、流行病学急性坏死性小肠结肠炎呈散发和流行趋势。
急性坏死性小肠结肠炎曾经有过几次大规模流行。
在第二次世界大战后的德国,饥饿中的人们进食大量肉食和蔬菜后发生急性坏死性小肠结肠炎,那时称为“darmbrand”,意思是“肠道燃烧”。
当营养状况改善后,本病在欧洲几乎消失。
1963年Murrell和Roth报道了巴布亚新几内亚高原的急性坏死性小肠结肠炎流行,是发生在食用大量甘薯和被猪肠污染而未加工熟的猪肉后,所以也叫做“pigbel”,意思是吃猪肉后发生的腹痛。
急性坏死性小肠结肠炎的暴发经常发生在蛋白质缺乏、食品条件差的地区。
例如1985年6月至1986年7月在泰柬边境有62个高棉儿童发病;本病曾经是巴布亚新几内亚高原儿童生病和死亡的主要原因,直到从1980年用C型产气荚膜梭状芽孢杆菌产生的β毒素进行免疫后,每年发病率下降至原来的1/8。
乌干达、泰国、印度、新加坡和斯里兰卡等国亦有散发病例报道。
柬埔寨的暴发病死率为58%。
发达国家很少见,1984年后美国报道2例,英国2例,澳大利亚1例,其中有3例有糖尿病。
有人认为糖尿病人易于发生急性坏死性小肠结肠炎,可能与植物神经功能紊乱导致的小肠通过时间延迟和胰腺萎缩后胰蛋白酶分泌减少有关。
在我国,珠江流域、长江流域以及山东、辽宁、北京、甘肃、四川、云南、贵州等地均有散在报道,其中辽宁和广东两省报道的病例最多。
农村发病率显著高于城市。

丁酸对新生儿坏死性小肠结肠炎新生小鼠模型的保护作用李秋平;余加林;胡坤;贺雨;肖洒;侯婷;艾青【期刊名称】《解放军医学杂志》【年(卷),期】2018(043)003【摘要】目的探讨丁酸在新生儿坏死性小肠结肠炎(NEC)新生小鼠中的作用及其可能机制.方法将60只3日龄C57BL/6新生小鼠按随机数字表法分为磷酸盐缓冲液(PBs)组(n=30)及丁酸组(n=30),分别予以PBS或丁酸溶液灌胃,1次/d,连续干预7d后,采用缺氧+冷刺激+人工喂养的方法连续3d刺激建立NEC模型,隔夜空腹处死新生鼠.HE染色观察回盲部肠组织病理变化并行双盲病理评分.采用实时荧光定量PCR检测白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、转化生长因子-β1(TGF-β1)及肿瘤坏死因子(TNF-α)基因表达水平;ELISA检测肠组织匀浆上清液IL-10、TGF-β1蛋白水平;采用流式细胞技术分析两组肠道固有层调节性T细胞(Treg)占CD4+T细胞比例.结果取标本时,丁酸组小鼠体重(4.50±0.42g)明显高于PBS组(4.16±0.60g,P<0.05);丁酸组生存率(76.34%)与PBS组生存率(67.95%)差异无统计学意义(P>0.05).肠组织病理损伤评分结果显示,丁酸组肠组织损伤评分[1.33(1.33~1.67)]明显低于PBS组[2.00(1.67~2.25),P<0.05].肠组织qPCR结果显示,丁酸组IL-6、TNF-α mRNA表达与PBS组比较明显降低(分别为0.85±0.30 vs.1.77±0.49,P<0.05;0.41±0.25 vs.0.96±0.56,P<0.05);而丁酸组IL-I0、TGF-β1 mRNA表达与PBS组比较明显升高(分别为1.91±0.82vs.0.94±0.43,P<0.05;1.46±0.57 vs.0.88±0.29,P<0.05).肠组织ELISA结果显示,丁酸组IL-10、TGF-β1蛋白表达水平与PBS组比较明显升高(分别为68.60±15.06 vs.37.25±5.81,P<0.05;424.93±19.34vs.127.31±60.83,P<0.05).流式细胞术分析结果显示,丁酸组肠道固有层Treg占CD4+T细胞比例较PBS组高(12.68%±6.79% vs.3.57%±0.88%,P<0.05).结论丁酸在NEC新生小鼠模型肠道损伤中起保护作用.其可能机制是丁酸下调炎症因子IL-6、TNF-α表达,上调细胞因子IL-10、TGF-β1的表达,促进T细胞向Treg细胞分化,从而发挥抑制炎症反应的作用.%Objective To investigate the protective effect of sodium butyrate on the neonatal mouse model of necrotizing enterocolitis and analyze its possible mechanism.Methods Sixty c57BL/6 neonatal mice were randomly divided into two groups (n=30):PBS group and butyric acid group.At the third day after birth,mice in both groups were respectively given PBS and sodium butyrate solution by gavage once a day for 7 days,and neonatal necrotizing enterocolitis (NEC) model was established by hypoxia,cold stimulation and artificial feeding.The newborn mice were sacrificed overnight after modeling.HE staining and double-blind pathological score were performed to observe the pathological changes of ileocecal intestinal tissue.The mRNA expressions of IL-6,IL-10,TGF-β1 and TNF-a were tested by quantitative real-time PCR.The levels of IL-10 and TGF-β1 in intestine tissues were evaluated using ELISA.Flow cytometry was used to analyze the ratio of regulatory T cells (Treg) on CD4+ T cells in both groups.Results When mice were sacrificed overnight after NEC modeling,the body weight was significantly higher in butyric acid group (4.50 ± 0.42g) than in PBS group (4.16 ± 0.60g,P<0.05);No significant difference (P>0.05) existed in survival rate of butyric acid group (76.34%) and PBS group (67.95%).The pathological damage score of intestinal tissue showed that the median score of intestinal injury was significantly lower inbutyric acid group [1.33(1.33-1.67)] than in PBS group [2.00(1.67-2.25),P<0.05].qPCR demonstrated that the expressions of IL-6 and TNF-α mRNA were obviously l ower in butyric acid group than in PBS group (0.85 ± 0.30 vs.1.77 ± 0.49 and 0.41 ± 0.25 vs.0.96 ± 0.56,respectively,P<0.05);and the expressions of IL-10 and TGF-β1 mRNA were markedly higher in butyric acid group than in PBS group (1.91 ± 0.82 vs.0.94 ± 0.43 and 1.46 ± 0.57 vs.0.88 ± 0.29,respectively,P<0.05);Intestinal tissue ELISA results showed that the expressions of IL-10 and TGF-β1 were higher in butyric acid group than in PBS group (68.60 ± 15.06 vs.37.25 ± 5.81 and 424.93 ± 19.34vs.127.31 ± 60.83,r espectively,P<0.05);Flow cytometry revealed that the proportion of regulatory T cells (Treg) of CD4+ T cells was higher in butyric acid group than in PBS group (12.68%± 6.79% vs.3.57%± 0.88%,P<0.05).Conclusions Butyric acid plays a protective effect in the intestinal injury of neonatal mouse model of necrotizing enterocolitis.The possible mechanism is that butyrate can down-regulate the expressions of cytokines IL-6 and TNF-o,up-regulate the expressions of cytokines IL-10 and TGF-β1,and promote the differ entiation of T cells into Treg cells.【总页数】5页(P201-205)【作者】李秋平;余加林;胡坤;贺雨;肖洒;侯婷;艾青【作者单位】400014 重庆重庆医科大学附属儿童医院新生儿科、儿童发育疾病研究教育部重点实验室、儿科学重庆市重点实验室、儿童发育重大疾病国家国际科技合作基地;400014 重庆重庆医科大学附属儿童医院新生儿科、儿童发育疾病研究教育部重点实验室、儿科学重庆市重点实验室、儿童发育重大疾病国家国际科技合作基地;400014 重庆重庆医科大学附属儿童医院新生儿科、儿童发育疾病研究教育部重点实验室、儿科学重庆市重点实验室、儿童发育重大疾病国家国际科技合作基地;400014 重庆重庆医科大学附属儿童医院新生儿科、儿童发育疾病研究教育部重点实验室、儿科学重庆市重点实验室、儿童发育重大疾病国家国际科技合作基地;400014 重庆重庆医科大学附属儿童医院新生儿科、儿童发育疾病研究教育部重点实验室、儿科学重庆市重点实验室、儿童发育重大疾病国家国际科技合作基地;400014 重庆重庆医科大学附属儿童医院新生儿科、儿童发育疾病研究教育部重点实验室、儿科学重庆市重点实验室、儿童发育重大疾病国家国际科技合作基地;400014 重庆重庆医科大学附属儿童医院新生儿科、儿童发育疾病研究教育部重点实验室、儿科学重庆市重点实验室、儿童发育重大疾病国家国际科技合作基地【正文语种】中文【中图分类】R722.1【相关文献】1.γ-羟基丁酸对神经细胞缺氧复氧损伤的保护作用与γ-氨基丁酸及其A受体的关系 [J], 赵庆杰;刘玉梅;宋冬晶;郜旭;苏志强2.新生儿ABO溶血病并发新生儿坏死性小肠结肠炎的高危因素分析 [J], 汪瑜;李占魁;张莉;于西萍3.咖啡因在帕金森病小鼠模型中神经保护作用的转录组学分析 [J], 郑余银;冯艺佳;阮青青;屠文展4.咖啡因在帕金森病小鼠模型中神经保护作用的转录组学分析 [J], 郑余银;冯艺佳;阮青青;屠文展5.益生菌预防新生儿ABO溶血并发新生儿坏死性小肠结肠炎的临床疗效分析 [J], 梅涛;李晓英;张琳;朱荣平因版权原因,仅展示原文概要,查看原文内容请购买。

坏死性小肠结肠炎动物模型具体方法及步骤原型物种人
来源人工喂养以及缺氧和冷刺激诱导的新生儿坏死性小肠结肠炎
模式动物品系SPF级新生SD大鼠,2日龄
实验分组实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组
实验周期1~2 weeks
建模方法雌雄不限,体重约5~10g。
新生大鼠出生48h内母乳喂养,自由摄食,与母鼠同笼;出生后48h随机分成模型组和对照组。
对照组新生大鼠出生48h后继续与母鼠同笼,鼠乳喂养,不进行缺氧冷刺激。
模型组新生大鼠出生48h后与母鼠分开,置入保育箱中并采用鼠乳代用品人工喂养,并定期给与缺氧冷刺激,以建立新生鼠坏死性小肠结肠炎动物模型;
NEC模型组:
1.新生大鼠与母鼠分离,放置在保育箱内(控制保育箱内温度28~30℃,湿度45%~65%),采用鼠乳代用品喂养。
采用5号静脉留置针定时经口插管喂养,第1天给予0.2ml/次,每4小时1次,随后每24h增加0.2ml/次,48h后逐渐增至0.4ml。
2.缺氧及冷刺激:将新生SD大鼠置入缺氧箱中,5%氧气+95%氮气10分钟,随即打开缺氧箱,取出新生鼠,随后将其置入冰箱冷藏室中,给予4℃刺激,持续10分钟,结束后放回保育箱。
每日2次,分别进行一次缺氧+冷刺
激,连续3d,最后一次缺氧+冷刺激后24h空腹断头处死大鼠,打开腹腔取出十二指肠下端至直肠上端的肠道组织。
应用疾病模型
1.外观表现及生长情况模型组新生大鼠在开始造模后相继岀现不冋程度地排黄绿色黏液稀便、消瘦,体重减轻,随后出现胃潴留、腹胀、腹泻、进奶量下降、嗜睡常卷缩而卧、活动度下降、反应迟钝,行动缓慢,且逐渐加重。
对照组新生大鼠进食及排使均正常,无腹胀及胃潴留,活动度良好,皮下脂肪丰满;
2. 小肠肉眼观改变进行拍照;
3. 记录每只小鼠每天体重,进食情况。
4. 标本制作白片,电镜固定标本,western blot , PCR标本以用户后续检测。
肠道组织病理学检查
取盲部近端肠管1cm置于固定液中固定,石蜡包埋,取冠状切面,HE染色在光镜下观察肠组织形态学改变。
新生大鼠回盲部病理切片,HE染色,光学显微镜病理观察显示:对照组回肠部结构完整,肠黏膜完好,上皮完整、连续,腺体排列规则,组织结构清楚、分泌功能活跃、固有层血管无扩张,肌层无异常,无炎性细胞浸润及溃疡。
模型组出
现绒毛脱落、坏死,绒毛结构消失,甚至肠穿孔;固有层多量淋巴细胞、噬细胞及中性粒细胞浸润。