实验 凝固点降低法测定分子量
- 格式:doc
- 大小:117.92 KB
- 文档页数:4

凝固点降低法测定分子量(3学时)一、目的要求1、掌握一种常用的分子量测定方法。
2、通过实验进一步理解稀溶液理论。
3、掌握贝克曼温度计的使用。
二、实验原理含非挥发性溶质的二组分稀溶液的凝固点低于纯溶剂的凝固点。
这是稀溶液的依数性之一。
当指定了溶剂的种类和数量后,凝固点降低值取决于所含溶质分子的数目,即溶剂的凝固点降低值与溶液的浓度成正比。
以方程式表示这一规律则有:(9.1)B f f f f b K T T T =−=∆*这就是稀溶液的凝固点降低公式。
式中Tf*为溶剂的凝固点,Tf 为溶液的凝固点,Kf 为质量摩尔凝固点降低常数,简称凝固点降低常数;bB 为溶质的质量摩尔浓度。
因为bB 可表示为:(9.2)A B BB m M m b =故(9.1)式可改为:(9-3)A fB f B m T m K M ⋅∆=式中,MB 为溶质B 的分子量;mB 和mA 分别为溶质和溶剂的质量(单位:千克)。
如已知溶剂的Kf 值,则可通过实验测出∆Tf 值,利用上式求溶质的分子量。
显而易见,全部实验操作归结为凝固点的精确测量,所谓凝固点是指在一定条件下,固液两相平衡共存的温度。
理论上,只要两相平衡就可达到这个温度。
但实际上,只有固相充分分散到溶液中,也就是固液两相的接触面相当大时,平衡才能达到。
一般通过绘制步冷曲线的方法来测定出凝固点。
图9.1冷却曲线(此图扫描自文献[2]p33图3-1)纯溶剂的凝固点是液相和固相共存的平衡温度,其步冷曲线如图9.1(Ⅰ)所示。
但实际过程中容易发生过冷现象,即过冷析出固体以后温度才回升到平衡温度,如图9.1(Ⅱ)所示。
溶液的凝固点是溶液的液相和溶剂的固相共存的平衡温度,其步冷曲线与纯溶剂不同,如图9.1(Ⅲ和Ⅳ)所示。
如果过冷严重,会出现图9.1(Ⅴ)所示,将会影响分子量的测定结果。
因此在实验中要控制适当的过冷程度,一般可通过控制寒剂的温度、搅拌的速度来控制。
三、仪器及试剂仪器:凝固点降低实验装置一套;贝克曼温度计一支,普通温度计一支(0-40℃,1/10刻度);烧杯(800mL)一只,移液管(25mL)一支;分析天平一台,放大镜一个。

实验三凝固点降低法测定分子量一、目的要求1、掌握溶液凝固点的测定技术。
2、掌握自冷式凝固点测定仪的使用方法。
3、用凝固点降低法测定物质的摩尔质量。
二、实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现。
由于溶质在溶液中有离解、缔合、溶剂化和络合物生成等情况,这些均影响溶质在溶剂中的表观分子量。
因此凝固点降低法不仅是一种简单而较正确的测定分子量的方法,还可用来研究溶液的一些性质。
非电解质稀溶液的凝固点降低值(对析出物为固相纯溶剂的体系)与溶液组成关系式为:δ77=t0~τ=κfbB(3-1)式中:ATf为溶液凝固点降低值,To为纯溶剂的凝固点,T为溶液的凝固点,bB为稀溶液的质量摩尔浓度,Kf称为凝固点降低常数,它是溶剂的特性常数与溶质的性质无关。
若已知某种溶剂的凝固点降低常数Kf,并测得溶剂和溶质的质量分别为mA)mB的稀溶液的凝固点降低值ATf,则可通过下式计算溶质的摩尔质量MboKfmftmb=^λ-(3-2)式中灼的单位为K∙kg∙mol-1o纯溶剂的凝固点为其液相和固相共存的平衡温度。
若将液态的纯溶剂逐步冷却,在未凝固前温度将随时间均匀下降,开始凝固后因放出凝固热而补偿了热损失,体系将保持液-固两相共存的平衡温度而不变,直至全部凝固,温度再继续下降。
其冷却曲线如图1中1所示。
但实际过程中,当液体温度达到或稍低于其凝固点时,晶体并不析出,这就是所谓的过冷现象。
此时若加以搅拌或加入晶种,促使晶核产生,则大量晶体会迅速形成,并放出凝固热,使体系温度迅速回升到稳定的平衡温度;待液体全部凝固后温度再逐渐下降。
冷却曲线如图1中2所示。
溶液的凝固点是该溶液与溶剂的固相共存的平衡温度,其冷却曲线与纯溶剂不同。
当有溶剂凝固析出时,剩余溶液的浓度逐渐增大,因而溶液的凝固点也逐渐下降。
因有凝固热放出,冷却曲线的斜率发生变化,即温度的下降速度变慢,如图1中3所示。
本实验要测定已知浓度溶液的凝固点。
如果溶液过冷程度不大,析出固体溶剂的量很少,对原始溶液浓度影响不大,则以过冷回升的最高温度作为该溶液的凝固点,如图1中4所示。

姓名: 肖池池序号: 31 周次: 第十四周指导老师: 张老师凝固点降低法测相对分子量一、实验目的1.测定水的凝固点降低值,计算萘的分子量。
2.掌握溶液凝固点的测定技术。
3.掌握FPD-2A/3A型凝固点温差测定仪的使用方法。
二、实验原理当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。
即ΔT f= - T f = K f m (1)式中,T f*为纯溶剂的凝固点,T f为溶液的凝固点,m B为溶液中溶质B的质量摩尔浓度,K f 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。
若称取一定量的溶质W B(g)和溶剂W A(g),配成稀溶液,则此溶液的质量摩尔浓度为错误!未找到引用源。
式中,M B为溶质的分子量。
将该式代入(1)式,整理得:若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值T,即可计算溶质的分子量M B。
通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶体,往往成为过冷溶液。
然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升,当放热与散热达到平衡时,温度不再改变。
此固液两相共存的平衡温度即为溶液的凝固点。
但过冷太厉害或寒剂温度过低,则凝固热抵偿不了散热,此时温度不能回升到凝固点,在温度低于凝固点时完全凝固,就得不到正确的凝固点。
从相律看,溶剂与溶液的冷却曲线形状不同。
对纯溶剂两相共存时,自由度f*=1-2+1=0,冷却曲线出现水平线段,其形状如图1所示。
对溶液两相共存时,自由度f*=2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,但回升到最高点又开始下降,所以冷却曲线不出现水平线段,如图5-2所示。
由于溶剂析出后,剩余溶液浓度变大,显然回升的最高温度不是原浓度溶液的凝固点,严格的做法应作冷却曲线,并按图2中所示方法加以校正。
但由于冷却曲线不易测出,而真正的平衡浓度又难于直接测定,实验总是用稀溶液,并控制条件使其晶体析出量很少,所以以起始浓度代替平衡浓度,对测定结果不会产生显著影响。

物理化学实验报告青海大学机械工程学院凝固点下降法测定物质分子量一.实验目的1.利用凝固点降低法测定稀溶液中溶质的分子量2.训练贝克曼温度计的使用二.实验原理i1.凝固点降低法测分子量的原理当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。
即ΔT=T f* - T f = K f b B (1) 式中,T f*为纯溶剂的凝固点,T f为溶液的凝固点,b B为溶液中溶质B的质量摩尔浓度,K f为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。
若称取一定量的溶质m B(g)和溶剂m A (g),配成稀溶液,则此溶液的质量摩尔浓度为 b B =1000m B/M B.m A,式中,M B为溶质的分子量。
将该式代入(1)式,整理得: M B = 1000 K f m B/ΔT. m A (g/mol) (2)若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值ΔT,即可计算溶质的分子量M B。
2.凝固点测量原理通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶体,往往成为过冷溶液。
然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升,当放热与散热达到平衡时,温度不再改变。
此固液两相共存的平衡温度即为溶液的凝固点。
但过冷太厉害或寒剂温度过低,则凝固热抵偿不了散热,此时温度不能回升到凝固点,在温度低于凝固点时完全凝固,就得不到正确的凝固点。
溶剂与溶液的冷却曲线形状不同。
对纯溶剂两相共存时,冷却曲线出现水平线段,其形状如图(a)所示。
对溶液两相共存时,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,但回升到最高点又开始下降,所以冷却曲线不出现水平线段,而斜率发生变化,如图(b)所示。
由于溶剂析出后,剩余溶液浓度变大,显然回升的最高温度不是原浓度溶液的凝固点,严格的做法应作冷却曲线,并按图(b)中所示方法加以校正。

实验9 凝固点降低法测分子量一、实验目的及要求1、用凝固点降低法测定环己烷的摩尔质量。
2、正确使用数字贝克曼(Beckmann )温度计,掌握溶液凝固点的测量技术。
3、通过本实验加深对稀溶液依数性的理解。
二、实验原理化合物的分子量是一个重要的物理化学参数。
用凝固点降低法测定物质的分子量是一种简单又比较准确的方法。
固体溶剂与溶液成平衡的温度称为溶液的凝固点。
含非挥发性溶质的双组分稀溶液的凝固点低于纯溶剂的凝固点。
凝固点降低是稀溶液依数性质的一种表现。
当确定了溶剂的种类和数量后,溶剂凝固点降低值仅取决于所含溶质分子数目。
对于理想溶液,根据相平衡条件,稀溶液的凝固点降低与溶液成分关系由范霍夫(van’t Hoff )凝固点降低公式给出 BA Am f f f n n n A H T R T +⨯=)()(2*∆∆ (2.1)式中,△T f 为凝固点降低值;T f *为纯溶剂的凝固点;△f H m (A )为摩尔凝固点热;n A 和n B 分别为溶剂和溶质的物质的量。
当溶液浓度很稀时,n B ≤n A ,则Bf B A m f f A Bm f f f m K m M A H T R n n A H T R T ≡⨯=⨯=)()()()(2*2*∆∆∆ (2.2)式中,M A 为溶剂的摩尔质量;m B 为溶质的质量摩尔浓度;K f 即称为质量摩尔凝固点降低常数。
如果已知溶剂的凝固点降低常数K f ,并测得此溶液的凝固点降低值△T f ,以及溶剂和溶质的质量W A 、W B ,则溶质的摩尔质量由下式求得fB K m =Af BW T W ∆ (2.3)应该注意,如溶质在溶液中有解离、缔合、溶剂化和配合物形成等情况时,不能简单地运用公式(2.3)计算溶质的摩尔质量。
显然,溶液凝固点降低法可用于溶液热力学性质的研究,例如电解质的电离度、溶质的缔合度、溶剂的渗透系数和活度系数等。
凝固点测定方法是将已知浓度的溶液逐步冷却成过冷溶液,然后促使溶液结晶;当晶体生成时,放出的凝固热使体系温度回升,当放热与散热达成平衡时,温度不再改变,此固液两相达成平衡的温度,即为溶液的凝固点。

凝固点降低法测化合物的分子量一、实验目的1.了解凝固点降低法测分子量的原理。
2. 熟悉冰点降低测定管和数字温度温差仪的使用方法。
3. 掌握溶液凝固点的测定技术和实验数据的作图处理方法。
二、实验原理1、物质的摩尔质量是一个重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的摩尔质量是一个简单而比较准确的测定方法,在实验和溶液理论的研究方面都具有重要意义。
2、凝固点降低法测分子量的原理当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。
即ΔT=T f* - T f = K f m B (1)式中,T f*—纯溶剂的凝固点T f —溶液的凝固点m B —溶液中溶质B的质量摩尔浓度K f ——溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。
表2-1给出了部分溶剂的凝固点降低常数值。
表2-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B(g)和溶剂W A(g),配成稀溶液,则此溶液的质量摩尔浓度m B为(2)式中,M B为溶质的分子量。
将(2)式代入(1)式,整理得: (3)若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值ΔT,即可计算溶质的分子量M B。
[注意]当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,不适用上式计算,一般只适用于强电解质稀溶液。
3、凝固点测量原理纯溶剂的凝固点是它的液相和固相共存时的平衡温度。
通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶体,往往成为过冷溶液。
然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升,当放热与散热达到平衡时,温度不再改变。
此固液两相共存的平衡温度即为溶液的凝固点。
但过冷太厉害或寒剂温度过低,则凝固热抵偿不了散热,此时温度不能回升到凝固点,在温度低于凝固点时完全凝固,就得不到正确的凝固点。
从相律看,溶剂与溶液的冷却曲线形状不同。

凝固点降低法测分子量实验所用体系的探讨
,尽量避免错别字
分子量测定是一项重要的实验,通过测定物质的分子量,可以获取物质的结构信息,为化学研究和制药研发提供重要依据。
传统的分子量测定使用沉淀法,受到测定温度的限制,有一定的局限性。
现在,采用凝固点降低法来测定物质的分子量已经成为化学界的一种共识,下面我们来探讨下凝固点降低法测分子量实验所用体系的组成。
凝固点降低法是基于溶液的冷凝熔融峰的变化,组成该实验所用体系时,应该首先考虑使用某种不连续,质子交换性惰性和能够可靠地除去多体系的共析组份的良好的可溶质有机溶剂。
之后应选择具有清楚分离峰的质子互换膜或凝胶,以及有限度干扰中性和极性样品的阳离子交换劑。
最后,通过控制实验温度和温度梯度,以及溶液浓度,以实现溶液熔融的降低,实现对物质的准确的分子量测定。
在实验中,样品应该通过质子交换或者逆流色谱,筛选成单一组份,以避免干扰实验结果。
此外,要使得实验更接近真实情况,还需要添加一些改善识别效果的添加剂,例如增加后 let 划,以获得更为准确的实验结果。
总结起来,凝固点降低法测分子量实验所用体系应安排具有某种不连续质子交换性惰性以及能够可靠除去多体系共析组份的良好可溶质有机溶剂、具有清晰分离峰的质子交换膜或凝胶、有限度干扰中性与极性样品的阳离子交换劑以及能够改善识别效果的添加剂等组份。
最后,通过控制温度和温度梯度,以及溶液浓度来获得准确的实验结果。

凝固点降低法测定分子量一、实验目的:用凝固点降低法测定萘的摩尔质量;通过实验了解掌握凝固点降低法测定摩尔质量的原理,加深对稀溶液依数性质的理解。
二、实验原理稀溶液具有依数性,凝固点降低是依数性的一种表现。
稀溶液的凝固点降低与溶液成分关系的公式为:ΔT f =)A (H )T (R m f 2*f ∆⨯M A ⨯m B =K f ⨯m B (1) 式中:ΔT f 为凝固点降低值;*f T 为纯溶剂A 的凝固点;)A (m f H ∆为纯溶剂A 的摩尔凝固热;M A 是溶剂A 的摩尔质量,m B 是溶质的摩尔浓度;K f 称质量摩尔凝固点降低常数,其数值只与溶剂的性质有关,当以水作为溶剂时,其K f 的值是1.84K·mol -1·kg 。
如果已知溶剂的质量摩尔凝固点降低常数K f 的值,并测得此溶液的降低值ΔT f ,以及溶剂和溶质的W A 和W B ,则溶质B 的摩尔质量由下式求得:M B =K fAf BW T W ∆ (2)纯溶剂的凝固点是其固-液共存的平衡温度。
将纯溶剂逐步冷却时,在未凝固之前温度将随时间均匀下降,至凝固点温度A 时开始凝固。
由于凝固过程放出凝固热而补偿了热损失,体系将保持固-液两相共存的平衡温度不变,即由A 至B 一直保持水平至C ,C 点时液体全部凝固,温度再继续均匀下降(见图1a )。
但在实际过程中经常发生过冷现象,溶剂温度到达A 点时并无固体凝结,温度继续下降至最低点D 时,才有固体开始析出,随着凝固热逐渐增加,溶剂温度逐渐上升至凝固点B 时,温度保持不变至C ,待所有溶剂完全凝固,温度再次下降。
溶液的凝固点是溶液与溶剂的固相共存时的平衡温度,其冷却曲线与纯溶剂不同。
如冷却过程中不发生过冷现象,则溶液温度下降至凝固点A 时,开始析出固体。
随着溶剂逐渐凝固析出,剩下溶液的浓度逐渐增大,因而溶液的凝固点也逐渐下降,即由A 下降至B 最后到C (见图1b )。

实验二_凝固点降低法测分子量实验目的:1. 理解和掌握凝固点降低法的原理。
2. 利用凝固点降低法测定溶液中非电解质的分子量。
实验原理:凝固点降低法是一种测定溶液中非电解质分子量的方法,也称为冰点降低法。
当溶质加入溶剂后,凝固点降低,冰点下降。
利用溶液凝固点的变化量与溶质摩尔浓度的关系计算溶质的分子量。
设T0为纯水的冰点,T为加入溶质后溶液的凝固点,则溶液中摩尔浓度为C的溶质分子量M可由以下公式得出:ΔT=T-T_0其中ΔT为凝固点下降的ΔT=k_f C量,kf为常量,被称为溶剂(纯净水)的冰点正比系数。
因此有:将化学计量数代入公式,可得:(ΔT_2/ΔT_1)×(M_1/M_2)=1其中,M1为标准品(已知分子量)的摩尔浓度,M2为要测定物的摩尔浓度,ΔT1和ΔT2分别为溶质加入溶剂前后的凝固点下降量。
实验仪器:低温恒温槽、测冰点仪、电子天平、吸水纸、试管。
实验材料:纯水、苏丹红标准品、苏丹红草酸钠溶液。
实验步骤:1.称取0.3g苏丹红草酸钠溶解于10ml纯水中,制备1.0×10^-2mol/L的苏丹红草酸钠溶液。
2.将纯净水加入测冰点仪的凝固管中,用低温恒温槽降温至0℃左右,记录下纯净水的冰点T_0。
3.取一定量的溶液(如小试,可取约1ml),滴加到测冰点仪的凝固管中,慢慢搅拌并降温,记录凝固点T。
4.测两个溶液的凝固点下降量,并根据上述原理计算出苏丹红草酸钠的分子量。
实验注意事项:1.实验时应严格控制储液、冷却和测定的温度,减小误差。
2.苏丹红草酸钠溶液在室温下易受潮,要避免受潮。
3.溶质加入凝固管中应充分搅拌溶解,避免组成不均致使实验结果失真。
实验结果:以苏丹红草酸钠为例,测定两次实验的数据如下表所示:样品编号苏丹红草酸钠溶解液质量/mg 50.0体积/mL 10.0测量凝固点前的时间 223.7 s测量凝固点后的时间 1802.0 s凝固点下降量9.9℃所用纯净水冰点0.0℃以苏丹红草酸钠为标准品,摩尔质量为240g/mol,笔者根据公式计算可得:C=C_1×V_1/V_2苏丹红草酸钠的摩尔浓度为1×10^-2mol/L,加入0.5ml到凝固管中,因此其摩尔浓度变为:C_1=C_2×V_2/V_1=0.5×1×10^-2/1=5×10^-4mol/LΔT=T-T_0=9.9-0=9.9℃得出苏丹红草酸钠的分子量:因此,以苏丹红草酸钠为溶质,其分子量约为27.1g/mol。
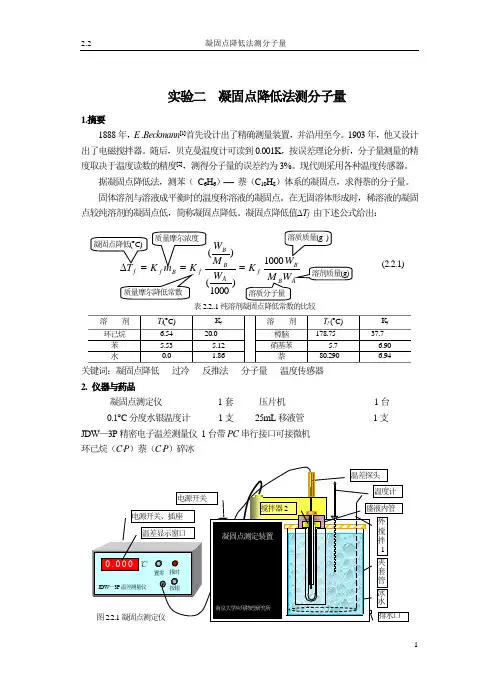
实验二 凝固点降低法测分子量1.摘要1888年,E .Beckmann [1]首先设计出了精确测量装置,并沿用至今。
1903年,他又设计出了电磁搅拌器。
随后,贝克曼温度计可读到0.001K ,按误差理论分析,分子量测量的精度取决于温度读数的精度[2],测得分子量的误差约为3%。
现代则采用各种温度传感器。
据凝固点降低法,测苯( C 6H 6)− 萘(C 10H 8)体系的凝固点,求得萘的分子量。
固体溶剂与溶液成平衡时的温度称溶液的凝固点。
在无固溶体形成时,稀溶液的凝固点较纯溶剂的凝固点低,简称凝固点降低。
凝固点降低值∆T f 由下述公式给出:f A B Bf K W M W )1000()(= 表2.2..1纯溶剂凝固点降低常数的比较关键词:凝固点降低 过冷 反推法 分子量 温度传感器 2. 仪器与药品凝固点测定仪 1套 压片机 1台0.1︒C 分度水银温度计 1支 25mL 移液管 1支 JDW —3P 精密电子温差测量仪 1台带PC 串行接口可接微机 环已烷(C ⋅P )萘(C ⋅P )碎冰(2.2.1)3.预习提问(1) 什么叫凝固点?凝固点降低法测分子量是研究哪一类相平衡体系(析出纯溶剂还是固溶体)?能否用于电解质溶液?你还知道哪些测分子量的方法。
(2) 纯溶剂和溶液的步冷曲线有什么差异?为什么会出现过冷现象?过冷现象对于本实验有无利弊?(3)为什么使用空气夹套?搅拌在实验中起何作用?(4) 称量纯溶剂及溶质时,精密度要求应否相同?(5) 如何设置纯溶剂与溶液凝固点的参照点?电子数显仪置零的意义何在?4.操作注意5.数据处理(1)溶剂的密度2-33-6步冷曲线记录次/半分凝固点测定记录(2)图象如图2.2.2所示。
a.. 纯溶剂出现一段稳定的平台,即达凝固点t 0。
过冷甚,可能出现回升温度最高点可能出现过平台 的情况。
∆T f b . 溶液的冷却曲线不同,随着纯溶剂的析出,溶 液中萘的相对浓度增大,凝固点依照简单低共熔相图中 液相线的规律不断下降,因为最初析出的纯溶剂是细晶, 具有较大的比表面积PT V A ,⎪⎭⎫⎝⎛∂∂,根据: 图2.2.2 步冷曲线 σμρ=⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫⎝⎛∂∂P T P T n A MV A,,/ (2.2.2) 细晶的化学势显然比通常两相平衡时的平板结晶的化学势要大。

实验二 凝固点降低法测定物质的相对分子质量一.实验目的1. 用凝固点降低法测定萘的相对摩尔质量;2. 掌握溶液凝固点测定技术;3. 通过实验加深对稀溶液依数性质的理解。
二.实验原理1. 稀溶液的依数性 (1)、溶液的蒸气压下降:Δp = poxB ≈ poMAbB = KbB (2)、溶液的沸点升高:ΔTb = kbbB (3)、溶液的凝固点降低:ΔTf = kfbB(4)、溶液的渗透压力:Π = cBRT利用溶液的沸点升高和凝固点降低都可以测定溶质的相对分子质量,但通常都用凝固点降低法。
原因:Kf > Kb , Tb > Tf2. 凝固点降低原理含非挥发性溶质的二组分稀溶液(当溶剂与溶质不生成固溶体时)的凝固点将低于纯溶剂的凝固点。
这是稀溶液的依数性质之一,当指定了溶剂的种类和数量后,凝固点降低值取决于所含溶质分子的数目,即溶剂的凝固点降低值与溶液的浓度成正比: m K T T T f =-=0这就是稀溶液的凝固点降低公式。
式中:T0为溶剂的凝固点;T 为溶液的凝固点;Kf 为质量摩尔凝固点降低常数,简称为凝固点降低常数;m 为溶质的质量摩尔浓度。
上式又可整理为:GT gKM f∙=1000式中:M 为溶质的摩尔质量(单位为g ·mol-1);g 和W 分别表示溶质和溶剂的质量(单位为g )。
3. 实验测量原理如已知溶剂的凝固点值,则可通过实验求出ΔT 值,利用(2)式求溶质的相对分子质量。
需要注意,如溶质在溶液中发生解离或缔合等情况,则不能简单地应用公式(2)加以计算。
浓度稍高时,已不是稀溶液,致使测得的相对分子质量随浓度的不同而变化。
为了获得比较准确的分子量数据,常用外推法,即以(2)式中所求得的相对分子质量为纵坐标,以溶液浓度为横坐标作图,外推至浓度为零而求得较准确的相对分子质量数值。
通常测凝固点的方法是将已知浓度的溶液(或溶剂)逐步冷却,记录一定时刻体系的温度,并绘出冷却曲线。
实验二凝固点降低法测定物质分子量实验二:凝固点降低法测定物质分子量引言:凝固点降低法是一种常用的测定物质分子量的方法。
其基本原理是根据溶质添加到溶剂中后,会引起溶液的凝固点下降,而凝固点的下降与溶质的分子量成正比关系。
因此,可以通过测量溶液的凝固点下降来计算溶质的分子量。
本实验将使用此方法来测定未知物质的分子量。
一、实验原理:凝固点降低的原理是根据溶质和溶剂之间的相互作用力。
在纯溶剂中,由于溶剂分子之间的相互作用力,会引起溶剂的凝固点。
而当溶质分子加入到溶剂中时,溶质分子与溶剂分子之间会发生相互作用,从而降低溶液的凝固点。
根据理论计算,溶液的凝固点降低与溶质的摩尔浓度成正比,与溶质分子量成反比。
具体计算公式为:ΔT = K × m × i其中,ΔT为溶液的凝固点下降,K为常数,m为溶质的摩尔浓度,i为溶质的离子数。
二、实验步骤:1. 准备实验所需材料,包括未知物质、溶剂、容量瓶、三角瓶、计算机和温度计。
2. 使用容量瓶准确称取一定质量的溶剂,加入三角瓶中。
3. 使用天平称取一定质量的未知物质,加入三角瓶中,轻轻搅拌使其充分溶解。
4. 在计算机上记录溶液的初始温度。
5. 将三角瓶放置在恒温水浴中,等待溶液温度稳定。
6. 在溶液温度稳定后,记录溶液的最终温度。
7. 计算溶液的凝固点下降(ΔT = 初始温度 - 最终温度)。
8. 根据溶液的凝固点下降和溶质的摩尔浓度计算溶质的分子量。
三、实验注意事项:1. 操作时要注意安全,避免溶液的溅洒和皮肤接触。
2. 在记录溶液温度时要准确,避免温度误差影响实验结果。
3. 溶液的摩尔浓度要准确计算,需要知道溶质的质量和溶液的总体积。
4. 实验结束后要及时清洗实验器材,保持实验室的整洁。
四、实验结果与讨论:根据实验得到的溶液的凝固点下降和溶质的摩尔浓度,可以计算出溶质的分子量。
实验结果的准确性受到多种因素的影响,如实验操作的准确性、仪器的精度等。
凝固点降低法测定物质分子量郑爱强 2010301040057(武汉大学化学与分子科学学院,湖北武汉 430072)摘要凝固点是溶液的液相与溶剂的固体成平衡时的温度。
凝固点下降法测定化合物的摩尔质量是一个简单而又较为准确的方法。
在溶液浓度很稀时,溶液凝固点降低值仅取决于所含溶质分子的数目,凝固点下降是稀溶液依数性的一种表现。
关键词凝固点凝固点下降法摩尔质量依数性1、实验目的(1)通过实验,熟悉用凝固点下降法测定溶质的摩尔质量的方法,加深对稀溶液依数性的理解;(2)掌握溶液凝固点的测量技术;2、实验原理当溶质与溶剂不生成固溶体,浓度很稀时,溶液的凝固点降低与溶质的质量摩尔浓度成正比:m K T f f ⋅=∆式中:f T ∆凝固点降低,K;m 溶质的质量摩尔浓度,1-⋅kg mol ;f K 凝固点降低常数,1-⋅⋅mol kg K ;已知:纯水K f =1.86;环己烷K f=20。
如果已知溶剂的质量摩尔凝固点降低常数f K 的值,并测得此溶液的降低值f T ∆,以及溶剂和溶质的W A 和W B 则溶质B 的摩尔质量可由下式求得:M B =K f W B /△T f W A由于过冷现象的存在,纯溶剂的温度要降到凝固点以下才析出固体,然后温度再回升到凝固点。
溶液冷却时,由于随着溶剂的析出,溶液浓度相应增大,故凝固点随溶剂的析出而不断下降,在冷却曲线上得不到温度不变的水平线段,一般地,溶液的凝固点应从冷却曲线上待温度回升后外推而得。
3、仪器药品仪器:冷冻管,空气套管,小烧杯两个,贝克曼温度计,25ml 移液管,水银温度计,搅拌棒等;药品:水,环己烷,萘,冰块。
4、实验部分(1)确定溶剂:量取25mg的待测未知物(分子量在120-200之间)于两个小烧杯中,分别用水和环己烷溶解,实验现象为水不能溶解,所以用环己烷作为溶剂。
(2)计算溶质用量:用环己烷作为溶剂,则凝固点每下降0.5℃,则每次应加58.12mg到96.86mg固体较合适,因此每次称取65mg左右。
实验一 凝固点降低法测定溶质的摩尔质量一、目的要求1.根据稀溶液的依数性质,利用凝固点降低法测定非电解质溶质摩尔质量。
2.掌握SWC-Ⅱ型精密数字温度温差测量仪的使用方法。
二、实验原理将一不挥发、非电解质溶于某溶剂时,溶液上方溶剂的蒸气压会比纯溶剂的蒸气压低,导致溶液的沸点升高,凝固点降低,并导致产生渗透压。
对于稀溶液,这些物理量的变化仅仅与溶液中溶质的质点的数目有关,而与溶质的本性无关,故称这些性质为稀溶液的“依数性”。
在纯溶剂中加入不挥发非电解质后,形成二组分溶液。
设纯溶剂的凝固点为T f *,溶液的凝固点为T f 。
如果溶液很稀,溶液凝固时可认为是固态纯溶剂的化学势μ1S (T ,p )和溶液中的溶剂的化学势μ1L (T ,p ,x 1)相等,即:1*1111ln ),(),,(),(x RT p T x p T p T L S +==μμμ 上式改写为:: RT G RT p T p T x S m*111),(),(ln ∆=-=μμ式中,∆G m -液态纯溶剂凝固为固态纯溶剂时的摩尔吉布斯能变化。
对上式求微分,根据吉布斯-亥姆霍兹公式可得:fus m 1m 2ln 11p p H x G T R T T R T ∆∂⎡∆⎤∂⎛⎫⎛⎫⎛⎫== ⎪ ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎝⎭⎣⎦ 式中,∆fus H m -纯溶剂的摩尔熔化焓。
对上式积分,得:dT RTH x d T T x ⎰⎰∆=f*f 12m fus 1 1ln 由于T f *和T f 相差不大,可将∆fus H m 看着常量*ff *f f m fus *f f m fus 1)(11ln T RT T T H T T R H x -∆-=⎪⎪⎭⎫ ⎝⎛-∆-=设:∆T f = T f *-T f ,T f *T f ≈ (T f *)2,稀溶液时(x 2很小),将对数项展开:221)1ln(ln x x x -≈-= 则: *2*f B f ff fus m A B()R T n T T T H n n ∆=-=⋅∆+ (1-1) 式中,T f *-纯溶剂的凝固点,K ;T f -溶液的凝固点;ΔT f -溶液的凝固点降低值;n A -溶剂的物质的量,mol ; n B -溶质物质的量;Δfus H m -溶剂摩尔熔化焓,J/mol 。
1实验9 凝固点降低法测分子量一、实验目的及要求1、用凝固点降低法测定环己烷的摩尔质量。
2、正确使用数字贝克曼(Beckmann )温度计,掌握溶液凝固点的测量技术。
3、通过本实验加深对稀溶液依数性的理解。
二、实验原理化合物的分子量是一个重要的物理化学参数。
用凝固点降低法测定物质的分子量是一种简单又比较准确的方法。
固体溶剂与溶液成平衡的温度称为溶液的凝固点。
含非挥发性溶质的双组分稀溶液的凝固点低于纯溶剂的凝固点。
凝固点降低是稀溶液依数性质的一种表现。
当确定了溶剂的种类和数量后,溶剂凝固点降低值仅取决于所含溶质分子数目。
对于理想溶液,根据相平衡条件,稀溶液的凝固点降低与溶液成分关系由范霍夫(van’t Hoff )凝固点降低公式给出 BA Am f f f n n n A H T R T +⨯=)()(2*∆∆ (2.1)式中,△T f 为凝固点降低值;T f *为纯溶剂的凝固点;△f H m (A )为摩尔凝固点热;n A 和n B 分别为溶剂和溶质的物质的量。
当溶液浓度很稀时,n B ≤n A ,则Bf B A m f f A Bm f f f m K m M A H T R n n A H T R T ≡⨯=⨯=)()()()(2*2*∆∆∆ (2.2)式中,M A 为溶剂的摩尔质量;m B 为溶质的质量摩尔浓度;K f 即称为质量摩尔凝固点降低常数。
如果已知溶剂的凝固点降低常数K f ,并测得此溶液的凝固点降低值△T f ,以及溶剂和溶质的质量W A 、W B ,则溶质的摩尔质量由下式求得fB K m =Af BW T W ∆ (2.3)应该注意,如溶质在溶液中有解离、缔合、溶剂化和配合物形成等情况时,不能简单地运用公式(2.3)计算溶质的摩尔质量。
显然,溶液凝固点降低法可用于溶液热力学性质的研究,例如电解质的电离度、溶质的缔合度、溶剂的渗透系数和活度系数等。
凝固点测定方法是将已知浓度的溶液逐步冷却成过冷溶液,然后促使溶液结晶;当晶体生成时,放出的凝固热使体系温度回升,当放热与散热达成平衡时,温度不再改变,此固液两相达成平衡的温度,即为溶液的凝固点。
本实验测定纯溶剂和溶液的凝固点之差。
纯溶剂的凝固点是它的液相和固相共存的平衡温度。
若将纯溶剂逐步冷却,理论上其冷却曲线(或称步冷曲线)应如图2—1(Ⅰ)所示。
但是实际过程中往往发生过冷现象,即在过冷而开始析出固体时,放出的凝固热才使体系的温度回升到平衡温度,待液体全部凝固后,温度再逐步下降,其步冷曲线呈图2—1(Ⅱ)形状。
过冷太甚,会出现如图2—1(Ⅲ)的形状。
溶液凝固点的精确测量,难度较大。
当将溶液逐步冷却时,其步冷曲线与纯溶剂不同,见图2—1(Ⅳ)、(Ⅴ)、(Ⅵ)。
由于溶液冷却时有部分溶剂凝固而析出,使剩余溶液的浓度逐渐增大,因而剩余溶液与溶剂固相的平衡温度也在逐渐下降,出现如图2—1(Ⅳ)的形状。
通常发生稍有过冷现象,则出现如图2—1(Ⅴ)的形状,此时可将温度回升的最高值t图2—1 步冷曲线示意图2近似地作为溶液的凝固点。
若过冷太甚,凝固的溶剂过多,溶液的浓度变化过大,则出现图2—1(Ⅵ)的形状,则测得的凝固点将偏低,必然会影响溶质的测定结果。
因此在测量过程中应该设法控制适当的过冷程度,一般可通过控制寒剂的温度、搅拌速度等方法来达到。
严格地说,纯溶剂和溶液的冷却曲线,均应通过外推法求得凝T f *点和T f 。
如图2—1(Ⅲ)曲线应以平台段温度为准。
如图2—1(Ⅵ) 曲线,则可以将凝固后固相的冷却曲线向上外推至与液相段相交,并以此交点温度作为凝固点。
有关讨论可参见有关章节。
三、仪器与试剂凝固点测定仪 1套 ; 数字式贝克曼温度计 1台; 普通温度计 1支; 25mL 移液管 1支; 秒表 1只 环己烷(分析纯);碎冰。
四、实验步骤 1、仪器安装检查仪器是否完好无损,装入冷水和碎冰,控制温度比被测系统的凝固点约低2℃~3℃(即2℃~3℃),冰水装入量控制在如图2—2位置。
2、调节数字贝克曼温度计将数字贝克曼温度计仪器电源打开,使其处于“温度-温差”测量状态(参见附录),预热10min 以上。
在将温度传感器插入样品试管内使它处于室温状态。
3、调节寒剂的温度调节冰水的量使寒剂的温度为3.5℃左右(寒剂的温度以不低于所测溶液凝固点3℃为宜)。
实验时寒剂应经常搅拌并间断地补充少量的碎冰,使寒剂温度基本保持不变。
4、溶剂凝固点的粗测用移液管准确吸取25mL 环已烷,加入凝固点管,加入的环已烷要足够浸没贝克曼温度计的传感器50mm ,但也不要太多,注意不要使环已烷溅在管壁上。
塞紧软木塞,以避免环已烷挥发,并记下溶剂温度。
先将盛有环已烷的凝固点管直接插入寒剂中,开动上下 移动搅拌器,使溶剂逐步冷却,当有固体析出时,将凝固点管自寒剂中取出,将管外冰水擦干,插入空气套管中,缓慢而均匀地搅拌之(约每秒一次)。
观、察贝克曼温度计读数,直至温度稳定,此乃环已烷的近似凝固点。
5、精确测量溶剂的凝固点取出冷凝管,用手温热之,使管内固体全部融化,然后放入空气套管中,将其逐步冷却并不断搅拌(注意:搅拌幅度不要太大,保证在溶液中进行,不许把溶液溅至管壁)。
待温度降至距粗测点0.2℃~0.3℃,时,打开秒表,同时迅速抽动搅棒,使晶体析出时迅速放出凝固热,防止出现过分的过冷现象,待温度上升时,缓慢搅拌,并记录下该点的温度,直至温度稳定。
视温度略有下降时,即停止搅拌。
在此过程中,注意观察数字温度显示仪器的温度变化。
五、数据处理 实验数据记录见下表:t/sT/℃ t/s T/℃ t/s T/℃ t/s T/℃ t/s T/℃ 0 7.002 70 6.462 140 6.48 215 6.464 270 6.45 5 6.946 75 6.439 150 6.48 225 6.463 275 6.449 106.905 80 6.421 155 6.477 230 6.462 280 6.448图2—2凝固点测试仪1—大玻璃筒、2—玻璃套管 3—温度计、4—被测物加入口、315 6.86 85 6.42 160 6.477 235 6.46 285 6.448 20 6.807 90 6.434 165 6.476 215 6.464 290 6.447 25 6.764 95 6.447 170 6.475 225 6.463 295 6.446 30 6.716 100 6.458 175 6.472 230 6.462 300 6.445 35 6.675 105 6.466 180 6.47 235 6.46 305 6.444 40 6.638 110 6.472 185 6.47 240 6.458 45 6.602 115 6.476 190 6.469 245 6.458 50 6.57 120 6.477 195 6.467 250 6.457 55 6.538 125 6.478 200 6.467 255 6.456 60 6.509 130 6.479 205 6.466 260 6.455 65 6.486 135 6.48 210 6.464 265 6.453根据上述数据作图如下:通过外推法,将凝固后固相的冷却曲线向上外推至与液相段相交,拟合得到的曲线方程为y=-2.1481*10^(-4)x+6.50981,交点坐标为6.499摄氏度。
所以环己烷的凝固点为6.499℃,已知环己烷的标准凝固点为6.5℃,测量相对误差为0.15%。
六、思考题1、为什么产生过冷现象?如何控制过冷程度?答: 纯溶剂的凝固点是液相和固相共存的平衡温度,实际过程中,过冷时才开始析出固体,放出的凝固热使温度回升至平衡温度,待液体全部凝固后,温度再逐步下降。
只有固液两相的接触面相当大时,固液才能达到平衡。
本实验过程中就是采取突然搅拌的方式和改变搅拌速度来达到控制过冷程度的目的,即当温度距离粗测点0.2℃~0.3℃,时,计时同时迅速抽动搅棒,使晶体析出时迅速放出凝固热,防止出现过分501001502002503003506.46.66.87.0t/sEquation y = a + b*x WeightNo WeightingResidual Sum of Squares 7.34763E-5Pearson's r -0.99254Adj. R-Square 0.9847ValueStandard ErrorB Intercept 6.509819.88431E-4BSlope-2.14841E-44.46186E-66.499T/℃4 的过冷现象,待温度上升时,缓慢搅拌,并记录温度,至温度稳定。
若温度略有下降时,即停止搅拌,实验结束。
2、根据什么原则考虑加入溶质的量?太多太少影响如何?答: 溶质的加入量应该根据它在溶剂中的溶解度来确定,因为凝固点降低是稀溶液的依数性,所以应当保证溶质的量既能使溶液的凝固点降低值不是太小,容易测定,又要保证是稀溶液这个前提。
如果加入量过多,一方面会导致凝固点下降过多,不利于溶液凝固点的测定,另一方面有可能超出了稀溶液的范围而不具有依数性。
过少则会使凝固点下降不明显,也不易测定并且实验误差增大。
3、为什么测定溶剂的凝固点时,过冷程度大一些对测定结果影响不大,而测定溶液凝固点时却必须尽量减少过冷现象。
答: 溶剂的冷却曲线后面是平台,过冷后温度达到平台即可,而溶液如果过冷程度大,浓度改变,作出的步冷曲线后面是向下的曲线,即使外推也达不到凝固点,使测量出的凝固点偏低。
4、B f f m K T =∆的关系在什么条件下才适用。
答:当溶液浓度很稀时,即n B ≤n A ,则B f f m K T =∆下才适用。