凝固点降低法测定物质的相对分子质量
- 格式:doc
- 大小:249.50 KB
- 文档页数:13

凝固点降低测相对分子质量实验四:凝固点降低法测相对分子质量一、实验目的(1)用凝固点降低法测定萘的相对分子量。
(2)掌握凝固点的测量技术,加深对稀溶液依数性的理解。
二、实验原理凝固点降低是稀溶液依数性的一种表现,当确定了溶剂的种类和质量后,溶液凝固点降低值仅决定于所含溶质分子的数目,而与溶质的本性无关。
稀溶液的凝固点降低与溶液组成的关系由范·霍夫(van't hoff )凝固点降低公式给出。
式中:ΔT f 为凝固点降低值;T f *为纯溶剂的凝固点;ΔH m,A 为溶剂的摩尔凝固热;n A 和n B 分别为溶剂的溶质的物质的量。
当溶液很稀时,即n A 远小于n B 时,则式中:M A 为溶剂的相对分子量;m B 为溶质的质量摩尔浓度;K f 为质量摩尔凝固点降低常数,简称为凝固点降低常数。
若此稀溶液中溶质的质量为W B ,溶剂质量为W A ,溶质的相对分子量为M B ,则:将式③代入式②得:如果已知溶剂的的凝固点降低常数K f ,并测得该溶液的凝固点降低值ΔT f 及溶剂和溶质的质量W A ,W B ,就可以通过④式求出溶质的相对分子量。
当溶质在溶液中有离解、缔合、溶剂化和络合物生成等情况存在时,会影响溶质在溶剂中的表观摩尔质量。
因此,溶液的凝固点降低发可用于研究溶液的电解质和电离度、溶质的缔合度、溶剂的渗透系数和活度系数等。
由此可见,实验的成功与否决定于凝固点的精确测量。
凝固点测定方法是将已知浓度的溶液逐渐冷却成过冷溶液,然后促使溶液结晶;当晶体生成时,放出的凝固热使体系温度回升,当放热与散热达成平衡时,温度不再改变,此固液两相达成平衡的温度,即为溶液的凝固点。
本实验测定纯溶剂和溶液的凝固点之差。
纯溶剂(单组分)在凝固前温度随时间均匀下降,当达到凝固点时,固体析出,放出热量,补偿了对环境的热散失,因而温度保持恒定,直到全部凝固后,温度再均匀下降,其冷却曲线见图中曲线(a)。
但实际上,只有固相充分分散到液相中,也就是固液两相的接触面相当大时,平衡才能到达,画出(a )冷却曲线。

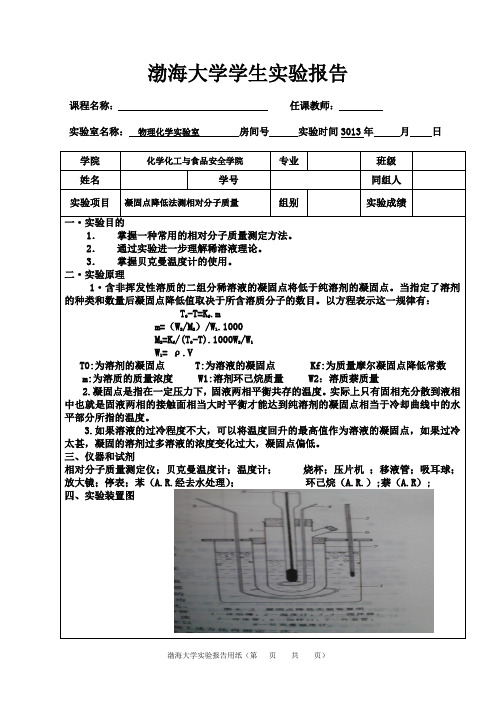
凝固点降低法测相对分子质量;实验注意事项;1、将已调好并擦干的贝克曼温度计插入冷冻管时;再;晶全部溶化时;把萘加入体系并使其溶解时;请注意:;2、每组(三次)数据测定时过冷程度要一致;3、使用贝克曼温度计时请先阅读教材P44的注意事;4、量取苯时应先读室温;思考题;1、凝固点降低法测相对分子质量的公式,在什么条件;2、在冷却过程中,冷冻管内固液相之间和寒剂之凝固点降低法测相对分子质量实验注意事项1、将已调好并擦干的贝克曼温度计插入冷冻管时;再次测量之前将体系温热、搅拌而使苯结晶全部溶化时;把萘加入体系并使其溶解时;请注意:绝不能让温度计中的水银柱与贮槽中的水银相接!2、每组(三次)数据测定时过冷程度要一致。
搅拌应无摩擦。
3、使用贝克曼温度计时请先阅读教材P44的注意事项,一定要小心!4、量取苯时应先读室温。
思考题1、凝固点降低法测相对分子质量的公式,在什么条件下才能适用?答:非挥发性溶质的稀溶液,适用于稳定的大分子化合物,浓度不能太大也不能太小。
2、在冷却过程中,冷冻管内固液相之间和寒剂之间有哪些热交换?它们对凝固点的测定有何影响?答:凝固点测定管内液体与空气套管、测定管的管壁、搅拌棒以及温差测量仪的传感器等存在热交换。
因此,如果搅拌棒与温度传感器摩擦会导致测定的凝固点偏高。
测定管的外壁上粘有水会导致凝固点的测定偏低。
3、当溶质在溶液中有离解,缔合和生成络合物的情况时,对相对分子质量测定值的影响如何?答:溶质在溶液中有解离、缔合、溶剂化和形成配合物时,凝固点降低法测定的相对分子质量为溶质的解离、缔合、溶剂化或者形成的配合物相对分子质量,因此凝固点降低法测定出的结果反应了物质在溶剂中的实际存在形式。
4、影响凝固点精确测量的因素有哪些?答:影响测定结果的主要因素有控制过冷的程度和搅拌速度、寒剂的温度等。
本实验测定凝固点需要过冷出现,过冷太甚会造成凝固点测定结果偏低,因此需要控制过冷程度,只有固液两相的接触面相当大时,固液才能达到平衡。

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 蔡跃鹏 实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、确定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f 比纯溶剂的凝固点T f *下降,其降低值△T f =T f *-T f 与溶液的质量摩尔浓度成正比,即△T f =K f m (3-1)式中,△T f 为凝固点降低值;m 为溶液质量摩尔浓度;K f 为凝固点降低常数,它与溶剂的特性有关。
表3-1给出了部分溶剂的凝固点降低常数值。
表3-1 几种溶剂的凝固点降低常数值若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为m B =×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。
将式(3-2)代入式(3-1),整理得M B = ×103mol/kg (3-3) 若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是M B W AW B △T f W AK f W B将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。

华南师大学实验报告【实验目的】①测定环己烷的凝固点降低值,计算萘的分子量。
②掌握溶液凝固点的测定技术。
③技能要求:掌握冰点降低测定管、数字温差仪的使 用方法,实验数据的作图处理方法。
【实验原理】1、凝固点降低法测分子量的原理化合物的分子量是一个重要的物理化学参数。
用凝固点降低法测定物质的分子量是一种简单而又比较准确的方法。
稀溶液有依数性,凝固点降低是依数性的一种表现。
稀溶液的凝固点降低(对析出物是纯溶剂的体系)与溶液中物质的摩尔分数的关系式为:ΔT f = T f * - T f = K f m B (1)*式中,T f *为纯溶剂的凝固点,T f 为溶液的凝固点,m B 为溶液中溶质B 的质量摩尔浓度,K f 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。
已知某溶剂的凝固点降低常数K f,并测得溶液的凝固点降低值ΔT ,若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为:3AB BB 10W M W m ⨯=mol/kg (2)将(2)式代入(1)式,则:3Af Bf B 10W T W K M ⨯∆=g/mol (3)表1 几种溶剂的凝固点降低常数值因此,只要称得一定量的溶质(WB )和溶剂(WA )配成一稀溶液,分别测纯溶剂和稀溶液的凝固点,求得ΔT f ,再查得溶剂的凝固点降低常数,代入(3)式即可求得溶质的摩尔质量。
* 当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,不适用上式计算,一般只适用于强电解质稀溶液。
2、凝固点测量原理纯溶剂的凝固点是它的液相和固相共存时的平衡温度。
若将纯溶剂缓慢冷却,理论上得到它的步冷曲线如图中的 A , 但但实际的过程往往会发生过冷现象,液体的温度会下降到凝固点以下,待固体析出后会慢慢放出凝固热使体系的温度回到平衡温度,待液体全部凝固之后,温度逐渐下降,如图中的B。
图中平行于横坐标的CD线所对应的温度值即为纯溶剂的凝固点T f*。

实验报告学生姓名学号专业化学(师范)年级班级课程名称物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型□验证 设计□综合实验时间年月日指导老师实验评分一、实验目的1.明确溶液凝固点的定义及获得凝固点的正确方法2.测定环己烷的凝固点降低值,用凝固点降低法测定萘的摩尔质量3.掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解4.掌握精密电子温差仪的使用方法二、实验原理∆T f=K f m B①∆T f为凝固点降低值,m B为溶液质量摩尔浓度,K f为凝固点降低常数,它与溶剂的特性有关m B=n B/W An B为溶质B的物质的量,W A为溶剂A的质量表1 环己烷的凝固点降低常数值溶质质量为W B(g)和溶剂W A(g)的稀溶液,此溶液的质量摩尔浓度m B为:×103mol/kg②m B=W BM B W AM B为溶质B的相对分子质量×103mol/kg由①②得,M B=K f W B∆T f W A对于纯溶剂,逐步冷却时,体系温度随时间均匀下降,到某一温度时有固体析出,由于结晶放出的凝固热抵消了体系降温时传递给环境的热量,因而保持固液两相平衡,当放热与散热达到平衡时,温度不再改变。
在步冷曲线上呈现出一个平台,当全部凝固后,温度又开始下降。
实际情况下,由于过冷现象的存在,往往每次测定值会有起伏。
即先过冷后足够量的晶体产生时,大量的凝固热使体系温度回升,回升后在某一温度维持不变,此不变温度作为纯溶剂的凝固点。
对于稀溶液,没有过冷现象存在时,溶液首先均匀降温,当某一温度有溶剂开始析出时,凝固热抵消了部分体系向环境的放热,因此降温变得缓慢,在步冷曲线上表现为一个转折点,此温度即为该平衡浓度稀溶液的凝固点,随着溶剂析出,溶液浓度增加,凝固点降低。
过冷现象存在时,某一浓度的溶液逐渐冷却成过冷溶液,通过搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热抵消了体系降温时传递给环境的热量,使体系温度回升,当凝固放热与体系散热达到平衡时,温度不再回升。


凝固点降低法测萘的相对分子质量凝固点降低法是一种测定溶液中物质相对分子质量的方法,其原理基于溶质的存在会影响溶剂的凝固点,因为溶液的凝固点低于纯溶剂的凝固点。
在一定浓度下,溶质与溶剂的比例越高,凝固点降低的越明显。
因此,可以根据凝固点的变化来计算溶液中物质的相对分子质量。
萘是一种简单的芳香族化合物,具有很强的吸收光谱,是经常用于光谱定量分析的标准样品。
在实验中,可以使用萘来进行凝固点降低法的相对分子质量计算。
实验步骤:1. 准备样品:称取1g的萘,加入100ml的乙醇,彻底搅拌均匀,使萘充分溶解于乙醇溶液中2. 准备对照组:取同样量的纯乙醇,作为对照组3. 降低凝固点:将样品及对照组装入两个蒸发皿中,将蒸发皿放置于恒温水槽中,在15~40℃的温度范围内,每隔5℃取出一次,记录下两个蒸发皿的凝固点4. 计算结果:根据凝固点降低公式,计算出两个样品的分子量,并比较得到样品的相对分子质量凝固点降低公式:ΔTf = Kf x m其中,ΔTf 是凝固点的降低,Kf 是凝固点降低常数(乙醇的Kf值为1.99 K kg/mol),m是溶液的摩尔浓度。
可以通过下式计算出样品的相对分子质量:M2/M1 = (ΔTf1/ΔTf2) x (m2/m1)其中,M1和M2分别表示溶质的相对分子质量和计算出的溶质相对分子质量,ΔTf1和ΔTf2表示对照组和样品的凝固点降低,m1和m2表示对照组和样品的分子浓度。
实验注意事项:1. 溶液的配制必须要精确,并且充分搅拌,以保证萘充分溶解于乙醇溶液中。
2. 游离萘可能会对实验环境造成污染,应注意实验室通风。
3. 选用合适的温度范围和温度间隔来保证准确的测量结果。
4. 实验过程中,需要控制实验环境的温度和湿度,尽量保持恒定。
5. 实验完毕后,将所有使用过的试剂和设备进行妥善处理和清洗,保持实验环境的整洁和安全性。
总之,通过凝固点降低法测萘的相对分子质量,不仅可以加深对化学物质的认识,而且可以加强实验技能的培养。

凝固一、仪器和药品1、仪器相对分子质量测定仪1套;贝克曼温度计1支温度计(0~50 0C)1支;烧杯(1000ml)1个压片机1台;移液管(20 ml)1支吸耳球1个;放大镜1个停表1块;2、药品苯(A.R.经去水处理);环己烷(A.R.);奈(A.R.);二、预习提问1、稀溶液的四个依数性质是什么?本实验利用了稀溶液依数性质的哪一个?数学表达式如何?各物理量的含义是什么?2、全部实验操作归结为什么的测量?何谓凝固点?3、纯溶剂的凝固点在图4-1中指的是什么?4、实验操作中应注意什么?三、实验注意事项1、凝固点的确定较为困难。
先测一个近似凝固点,精确测量时,在接近近似凝固点时,降温速度要减慢,到凝固点时快速搅拌。
2、千万不要过冷,若过冷太甚,凝固的溶剂过多,溶液的浓度变化过大,所得凝固点偏低。
凝固一、实验目的1、掌握一种常用的相对分子质量测定方法。
2、通过实验进一步理解稀溶液理论。
二、基本原理利用稀溶液的冰点降低依数性质测定相对分子质量。
冰点降低(凝固点降低)即含非挥发性溶质的二组分稀溶液的凝固点将低于纯溶剂的凝固点。
数学表达式为 m K T T T f ⋅=-=∆0 (1)式中:0T 为纯溶剂的凝固点;T 为溶液的凝固点;f K 为质量摩尔凝固点降低常数,简称为凝固点降低常数;m 为溶质的质量摩尔浓度。
又因为 1000/⨯=WMg m (2) 式中:M 为溶质的摩尔质量(1-⋅mol g );g 和W 分别表示溶质和溶剂的质量(g )。
将(2)式代入(1)式得WT gK M f ⋅∆⋅=1000全部实验操作归结为凝固点的精确测量。
所谓凝固点是指在一定压力下,固液两相平衡共存的温度。
测定溶剂、溶液温度随时间的变化,绘制得步冷曲线,而得到溶剂、溶液的凝固点。
注意实验操作中必须掌握体系的过冷程度。
三、装置图 四、操作步骤1、将仪器安装好,取自来水注入冰浴槽中(水量以注满浴槽体积2/3为宜),然后加入冰屑以保持水温在3~50C 。

西安交通大学实验报告课程:物理化学实验 系别:专业班号: 组别:第二大组 实验日期:2015年4月3日 姓名: 学号: 交报告日期:2015年4月10日 同组者:实验名称:凝固点降低法测定相对分子质量一、实验目的1.用凝固点降低法测定萘的相对分子量。
2.掌握步冷曲线法测定液体凝固点的方法。
3.掌握数字贝克曼温度计的使用方法。
二、实验原理稀溶液中溶剂的蒸气压下降、凝固点降低(析出固态纯溶剂)、沸点升高(溶质不挥发)和渗透压的数值,仅与一定量溶液中溶质的质点数有关,而与溶质的本性无关,故称这些性质为稀溶液的依数性。
固体物质和它的液体成平衡时的温度称为凝固点。
加一溶质于纯溶剂中,其溶液的凝固点必然较纯溶剂的凝固点低,其降低的数值与溶液中溶质的质量摩尔浓度成正比。
对于在溶液中不离解、不缔合的溶质的稀溶液有如下关系式:0T T T kc ∆=-= ① 式中:0T —纯溶剂的凝固点; T —浓度为C 的溶液的凝固点; k —比例常数。
如果C 以质量摩尔浓度(B m :每千克溶剂所含溶质的物质的量)来表示,k 则为溶剂的摩尔凝固点降低常数,今以f K 表示这个常数,于是①示可改写为: 0f B T T T K m ∆=-= ②若取一定量的溶质()B W 和溶剂()A W 配制成稀溶液,则此溶液的质量摩尔浓度B m 为: /1000B BB AW M m W =⨯ ③式中:B m 为溶质的相对分子质量。
如果已知溶剂的f K 值,则测定此溶液的凝固点降低值即可按下式计算溶质的相对分子质量。
01000fBB AK W M T T W =⨯- ④纯溶剂的凝固点是它的液相和固相共存的平衡温度。
若将纯溶剂逐步冷却,其冷却曲线如图1中Ⅰ的曲线图形。
但实际过程中往往发生过冷现象,即在过冷时开始析出固体后,温度才回升到稳定的平衡温度,当液体全部凝固后,温度再逐渐下降,其冷却曲线呈现如图1中Ⅱ的形状。
溶液的凝固点是该溶液的液相与溶剂的固相共存的平衡温度。

凝固点降低法测定物质的相对分子质量一.实验目的用凝固点降低法测定萘的相对摩尔质量掌握溶液凝固点测定技术通过实验加深对稀溶液依数性质的理解二.实验原理凝固点降低法是一种比较简单而准确的测定相对摩尔质量的方法,凝固点降低是理想稀溶液的依数性质之一。
理想稀溶液的凝固点降低(对析出物为纯固相溶剂的体系)与溶液组成之间的关系为∶2,()f f f f B fus m A R T T T T x H ***∆=-=∆式中∶ f T *为纯溶剂的凝固点(K), f T ∆为凝固点降低值(K), f T 为稀溶液的凝固点(K), B x 为溶液中溶质的摩尔分数。
,fus m A H *∆为纯溶剂的摩尔凝固焓。
当溶液的浓度很稀时,上式可改写为∶22,,()()()()()()()()f f A f A f fus m A B fus m A B B R T R T n m B m B T M k H n H M m A M m A ****∆===∆∆ f k 为凝固点降低常数,()m A 为溶剂的质量,()m B 为溶质的质量,A M 为溶剂的摩尔质量,B M 为溶剂的摩尔质量,称取()m B /kg 的溶质和()m A /kg 溶剂配成理想稀溶液,分别测定纯溶剂和溶液的凝固点,求得凝固点降低值f T ∆ (K),再查得溶剂的凝固点降低常数,代入上式即可计算溶质的相对摩尔质量B M 。
通常测凝固点的方法是将已知浓度的溶液(或溶剂)逐步冷却,记录一定时刻体系的温度,并绘出冷却曲线。
纯溶剂的凝固点是它的液相和固相共存时的平衡温度,在冷却曲线上为水平线所处之温度。
但将在实际冷却过程中,常发生过冷现象,在开始析出固体后温度才回升并会稳定一段时间,在冷却曲线水平线段的左端出现一向下弯曲的曲线。
溶液的凝固点是该溶液的液相和溶剂的固相共存时的平衡温度。
若将溶液逐步冷却,随着溶剂固体的析出,冷却曲线出现转折点,若适当控制冷却速率(如∶ 控制寒剂的温度或搅拌速度等),使得过冷现象不严重,可得到较好的实验结果,否则实验结果将偏低。

凝固点降低法测定相对分子质量嘿,朋友们,今天咱们聊聊一个听起来挺高大上的话题——凝固点降低法测定相对分子质量。
乍一听,哎呀,感觉像是化学课上老师讲的那些复杂的公式,结果一头雾水。
不过别怕,今天我就用最简单易懂的语言,把这事儿说清楚。
什么是凝固点降低法呢?简单来说,就是通过观察某种溶液的凝固点变化,来推算出溶质的分子质量。
想象一下,你在寒冷的冬天喝热巧克力,里面加了一点盐。
你会发现,咦,原本应该很快就能凝固的热巧克力,怎么变得这么难以凝固了?对,就是盐的功劳。
盐的加入降低了液体的凝固点。
这一现象就叫凝固点降低。
这方法听上去有点神奇,但其实它背后的原理并不复杂。
说白了,溶质的加入会影响溶剂的性质。
就像一群小朋友在公园里玩耍,如果多了几个朋友,大家就得排队等着玩秋千,变得不那么快了。
溶质越多,凝固点就越低。
科学家们通过测量这种变化,能够算出溶质的分子质量。
哇,听起来是不是有点酷?咱们得用点儿实际操作来让这事儿变得生动。
想象一下,咱们在实验室里,准备一些冰水和要测定的溶质,比如说,氯化钠。
咱们把冰水倒进一个烧杯,然后慢慢加氯化钠,搅拌均匀。
每加一点盐,咱们就要记录一下温度。
温度表就像是个小侦探,随着咱们的操作,慢慢揭开真相。
随着盐的增加,水的凝固点逐渐下降,直到咱们终于可以确定出这个神秘溶质的分子质量。
这个过程就像是在解谜,越加越有意思。
哎呀,想想那些化学反应,真是让人感到一阵兴奋。
你看,凝固点降低法不仅仅是个冷冰冰的实验,它背后其实有着无数的化学故事和科学原理。
每当我在实验室看到那一片片白色的盐溶解在水中,就像是在观察魔法一样,真是让人兴奋得想要大喊。
说到这里,有没有朋友想要亲自尝试一下呢?其实不需要太多复杂的仪器,咱们在家里也能做一个简单的实验。
找一个小碗,放点水,再加点盐,搅拌搅拌,看着盐在水中慢慢溶解。
然后,试着用冰块降温,看看水在什么温度下开始凝固。
这个过程就像是冬天的冒险,既好玩又能学到东西,简直是一举两得。

标准知识格式文章:凝固点降低法测定相对分子质量实验报告1. 概述在化学实验中,凝固点降低法是一种常用的方法,用于测定溶质的相对分子质量。
本文将结合理论知识和实验数据,探讨凝固点降低法在测定相对分子质量中的应用,以及实验过程中所遇到的问题和解决方法。
2. 理论知识凝固点降低法是指在非电解质溶液中,随着溶质浓度的增加,溶液的凝固点会降低。
这一现象可以用冰点降低公式ΔT = Kf·m来描述,其中ΔT为溶液的凝固点降低,Kf为溶剂的凝固点降低常数,m为溶质的摩尔浓度。
通过实验测定溶液的ΔT和溶质的摩尔浓度,就可以计算出溶质的相对分子质量。
3. 实验过程在实验中,首先准备一定浓度的溶液,并测定其凝固点。
然后逐步增加溶质的量,再次测定凝固点。
根据测得的数据,可以计算出溶质的相对分子质量。
在实验中,我们遇到了一些问题,比如溶液的搅拌不均匀、温度的测量误差等。
针对这些问题,我们采取了相应的措施,保证了实验的准确性。
4. 实验结果及分析通过实验数据的处理和计算,我们得出了溶质的相对分子质量。
在实验中,我们发现溶液的凝固点与摩尔浓度呈线性关系,符合理论预期。
这说明凝固点降低法是一种有效测定相对分子质量的方法,能够为化学实验提供可靠的数据支持。
5. 个人观点凝固点降低法是化学实验中常用的方法之一,对于测定非电解质的相对分子质量具有重要意义。
通过实验,我们不仅可以加深对理论知识的理解,还可以培养实验操作的技能。
在今后的学习和科研中,我将继续深入探讨凝固点降低法在化学领域的应用,并不断提升自己的实验能力。
6. 总结通过本次实验,我对凝固点降低法的原理和应用有了更深入的认识。
我也意识到实验中的细节操作对结果的影响至关重要。
在今后的学习中,我将继续努力,不断完善实验技能,为将来的科研打下坚实的基础。
结语凝固点降低法在测定相对分子质量中具有重要的应用价值,在化学实验中发挥着重要作用。
通过本次实验,我对凝固点降低法有了更深刻的理解,也提升了自己的实验技能。

【精品】实验六凝固点降低法测定物质的相对分子质量实验六凝固点降低法测定物质的相对分子质量一、实验目的:1、了解凝固点降低法;2、了解分子质量;3、测定未知物质的相对分子质量;二、实验原理:凝固点降低法是根据溶质前后溶解度的差异,比较物质不同组成结构前后溶解度的变化来计算物质的相对分子质量。
溶质的溶解度受到其含量和分子量的影响,因此可以利用凝固点的变化来推导出溶质的相对分子质量。
三、实验器材:常用:烧杯、吹管、滴定管、分液漏斗、拉曼光谱、静电精密秤等。
四、试剂:主要:未知物质、乙醇、氯仿、水。
五、实验方法:(1)称取一定量的未知物质,放入烧杯中,加入乙醇溶液,微摇,溶液放置步 4 小时,沉淀完全后,将沉淀物用滴定管吸出,用烧瓶内液体相同量的氯仿补充溶液内液体,微摇,之后再放置一段时间,等待沉淀完全即可。
(2)取拉曼光谱仪测量后,来判断溶液是否完全清晰,如果清晰,表示未知物质全部沉淀,记录称量的比例。
(3)静电精密秤取 10mL 的水,加入未知物质溶液,用烧杯内液体相同量的氯仿补充水内液体,微摇,放置一段时间等待沉淀完全,再用滴定管将沉淀物吸取,用静电精密秤称量,并记录称量的比例。
(4)将乙醇中溶质和氯仿中溶质的称量比例,以及水中溶质的称量比例相减,然后将得到的分子质量值代入以下公式,得到物质的相对分子质量。
相对分子质量=(重量质量 - 空白质量) / 称量比例六、安全事项:1、实验过程中进行时,请勿将助剂向眼、口中含服;2、实验完成后,严禁将残留于容器中溶质排放;3、对于有易燃、可爆炸、剧毒、有毒等潜在风险的溶质,必须严格按照实验的要求和安全规定进行实验;4、进行实验时,注意实验步骤、安全规定,避免操作时出现意外。
七、数据处理与分析:1、观察各容器中溶液过程和沉淀情况,判断未知物质的溶解度;2、计算未知物质的相对分子质量,用公式求出相对分子质量;3、使用拉曼光谱分析溶液,确定溶质中含有的分子结构;4、总结实验结果,得到未知物质的相对分子质量,并解释它们之间的关系。


华南师范大学实验报告学生姓名学号专业化学(师范)年级班级课程名称物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型□验证□设计√综合实验时间2013年11月19日实验指导老师肖信实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、测定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有很多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都有重要意义。
凝固点降低法是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f比纯溶剂的凝固点T*f下降,其降低值△T f=T*f-T f与溶液的质量摩尔浓度成正比,即△T f=K f m (1)式中,△T f为凝固点降低值,m为溶液质量摩尔浓度,K f为凝固点降低常数,它与溶液的特性有关。
下表给出了部分溶剂的凝固点降低常数值。
若称取一定量的溶质W B(g)和溶剂W A(g),配成稀溶液,则次溶液的质量摩尔浓度m B为:m B=[W B/(M B W A)]×103 mol/kg (2)式中,M B为溶质的相对分子质量,将式(2)代入式(1)整理得M B=[(K f W B)/△T f W A] ×103 g/mol (3)若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值△T f,即可计算溶质的相对分子质量M B。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘制出步冷曲线,用外推法求得纯溶剂或稀溶液中溶剂的凝固点。

实验4 凝固点降低法测相对分子质量一、实验目的(1)用凝固点降低法测定萘的相对分子质量(2)掌握凝固点的测量技术,加深对稀溶液依数性的理解二、实验原理1.凝固点降低是稀溶液的依数性之一, 当指定溶剂的种类和数量后, 稀溶液凝固点下降的数值只与所含溶质B分子的质点数有关, 而与溶质的本性无关。
稀溶液的凝固点降低与溶液组成的关系由Van’t hoff凝固点降低公式有:溶质在溶液中有离解、缔合和络合物生成等情况存在,都会影响在溶剂中的表观分子量。
因此可通过凝固点降低的方法研究溶液的电解质电离度、溶质的缔合度,溶剂的渗透系和活度系数等。
2.纯溶剂的凝固点是其液-固共存时的平衡温度。
将纯溶液逐步冷却时,在未凝固之前温度随时间均匀下降。
开始凝固后由于放出凝固热而补偿了热损失,温度将保持不变,直到全部液体凝固再继续均匀下降(如1)。
但在实际过程中常常发生过冷现象而使得情况与此有所不同,过冷现象是当液体冷却到达甚至低于其凝固点时,由于新相形成的困难,故此结晶并不析出;若此时对液体加以搅拌或加入晶体,促使晶核产生,则大量晶体会很快形成,放出凝固潜热使体系温度迅速回升,温度上升最高点即为凝固点(如2)。
对纯溶剂来说,凝固点是固定不变的,因为这时自由度为零。
而溶液的冷却曲线与纯溶剂不同,当有溶剂凝固析出时,剩下溶液的浓度逐渐增大, 因而溶液的凝固点逐渐降低(如3,4)若过冷太甚,凝固的溶剂过多,溶液浓度变化过大,测得的凝固点偏低。
因此溶液凝固点的精确测量,难度较大。
测量过程中应设法控制过冷程度,一般可测量调节制冷介质的温度,控制搅拌速度等方法达到三、仪器与试剂1、仪器:SWC-LG凝固点下降实验仪(温度/温差分辨率:0.01℃/0.001℃)煤油温度计(0~300℃)一支,移液管(25ml)一支,500ml大烧杯一个2、试剂:环己烷(A.R.),萘(A.R.),冰四、实验装置图五、实验步骤1.往筒中加入适量水(约2/3)后,慢慢加入冰块降温,观察温度计的示数,当温度降到3℃左右时即可。
华南师范大学实验报告学生姓名学号专业化学(师范)年级班级课程名称物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型□验证□设计√综合实验时间2013年11月19日实验指导老师肖信实验评分【实验目的】1、明确溶液凝固点的定义及获得凝固点的正确方法。
2、测定环己烷的凝固点降低值,计算萘的相对分子质量。
3、掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解。
4、掌握贝克曼温度计的使用方法。
【实验原理】物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有很多种。
凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都有重要意义。
凝固点降低法是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f比纯溶剂的凝固点T*f下降,其降低值△T f=T*f-T f与溶液的质量摩尔浓度成正比,即△T f=K f m (1)式中,△T f为凝固点降低值,m为溶液质量摩尔浓度,K f为凝固点降低常数,它与溶液的特性有关。
下表给出了部分溶剂的凝固点降低常数值。
若称取一定量的溶质W B(g)和溶剂W A(g),配成稀溶液,则次溶液的质量摩尔浓度m B为:m B=[W B/(M B W A)]×103 mol/kg (2)式中,M B为溶质的相对分子质量,将式(2)代入式(1)整理得M B=[(K f W B)/△T f W A] ×103 g/mol (3)若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值△T f,即可计算溶质的相对分子质量M B。
通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。
本实验采用后者。
其基本原理是将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘制出步冷曲线,用外推法求得纯溶剂或稀溶液中溶剂的凝固点。
通常测定凝固点的方法是将溶液逐渐冷却,使其结晶。
但是,实际上溶液冷却到凝固点,往往并不析出晶体,这是因为新相形成需要一定的能量,故结晶并不析出,这就是所谓过冷现象。
然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升。
从相律看,溶剂与溶液的冷却曲线形状不同。
对纯溶剂,固-液两相共存时,自由度f=1-2+1=0,冷却曲线出现水平线段,其形状如图1(1)所示。
对溶液,固-液两相共存时,自由度f=2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,回升到最高点又开始下降,所以冷却曲线不出现水平线段此时应按图1(3)所示方法加以校正。
(1)理想状态下的溶剂(2)有过冷的溶剂(3)有过冷的溶液【仪器和试剂】一、仪器:凝固点测定仪、贝克曼温度计、普通温度计、25mL移液管、烧杯二、试剂:环己烷、萘【实验步骤】1、调整贝克曼温度计,调节冷却剂温度,使冷却剂温度约为4℃左右。
2、溶剂凝固点测定:(1)用移液管向清洁、干燥的凝固点管内加入25mL环己烷,插入贝克曼温度计,不要碰壁与触底。
(2)先将盛有环己烷的凝固点管直接插入寒剂中,均匀搅拌,使环己烷的温度逐渐降低,当冷到4℃左右,要快速搅拌,幅度尽可能小,待温度回升后,恢复原来的搅拌速度,同时观察贝克曼温度计的示数,直到温度回升稳定为止,此温度即为环己烷的近似凝固点。
(3)取出凝固点管,用手捂住管壁片刻,同时不断搅拌,使管中固体全部融化,将凝固点管放在空气套管中,缓慢搅拌,使温度逐渐降低,当温度降至近似凝固点时,自支管加入少量晶种,并快速搅拌,待温度回升后,再改为缓慢搅拌,直到温度回升到稳定为止,记下稳定的温度值,重复测定三次,取三次平均值。
3、溶液凝固点的测定:取出凝固点管,如前将管中冰融化,称取约0.3g萘,自凝固点管支管加入样品,待全部溶解后,测定溶液的凝固点。
测定方法与测定环己烷的相同。
重复三次,取平均值。
【数据处理】1、由环己烷的密度,计算所取环己烷的质量W A。
环己烷的密度为0.779g/mL,所取体积V=25mL,故W A=0.779g/mL×25mL=19.475g2、数据记录:(1)环己烷第一次凝固:时间/10s 温度/℃时间/10s温度/℃1 7.333 19 6.4822 7.084 20 6.4843 6.894 21 6.4854 6.755 22 6.4865 6.656 23 6.4866 6.582 24 6.4867 6.545 25 6.4858 6.524 26 6.4859 6.501 27 6.46810 6.5 28 6.46411 6.498 29 6.4712 6.496 30 6.47213 6.493 31 6.46914 6.491 32 6.46315 6.489 33 6.45616 6.487 34 6.44617 6.484 35 6.44218 6.484作图得:由图可得T f1=6.527℃(2) 环己烷第二次凝固:作图得:时间/10s温度/℃ 时间/10s温度/℃ 1 8.367 20 6.727 2 8.25 21 6.673 3 8.143 22 6.613 4 8.029 23 6.554 5 7.921 24 6.502 6 7.819 25 6.45 7 7.719 26 6.428 8 7.627 27 6.447 9 7.545 28 6.464 10 7.457 29 6.472 11 7.369 30 6.473 12 7.285 31 6.476 13 7.204 32 6.474 14 7.129 33 6.47 15 7.053 34 6.468 16 6.984 35 6.468 17 6.915 36 6.464 18 6.849 376.46519 6.791由图可得T f2=6.501℃(3)环己烷第三次凝固:时间/10s温度/℃时间/10s温度/℃1 7.382 12 6.4812 7.18 13 6.4773 6.9 14 6.4744 6.793 15 6.4715 6.634 16 6.4696 6.539 17 6.4677 6.504 18 6.4648 6.495 19 6.4629 6.491 20 6.4610 6.487 21 6.45711 6.485作图得:由图可得T f3=6.524℃(4)环己烷第四次凝固:时间/10s温度/℃时间/10s温度/℃1 7.429 16 6.4792 7.209 17 6.4773 7.048 18 6.4764 6.9 19 6.4745 6.788 20 6.4736 6.698 21 6.4697 6.623 22 6.4688 6.566 23 6.4679 6.524 24 6.46710 6.495 25 6.46611 6.489 26 6.46512 6.488 27 6.46513 6.485 28 6.46414 6.481 29 6.46115 6.481 30 6.457作图得:由图可得T f4=6.500℃四次取平均值为:T f=6.513℃(5)溶液第一次凝固:时间/10s温度/℃时间/10s温度/℃1 5.532 11 4.9042 5.451 12 4.8553 5.379 13 4.8014 5.285 14 4.7625 5.203 15 4.7176 5.155 16 4.6817 5.096 17 4.658 5.046 18 4.6269 4.998 19 4.58810 4.948作图得:由图可得T f1*=4.626℃(6)溶液第二次凝固(第二组数据由于实验过程中发现水温不够,所以丢弃第二组数据):时间/10s温度/℃时间/10s温度/℃1 5.343 14 4.6842 5.268 15 4.6483 5.202 16 4.6084 5.159 17 4.5775 5.093 18 4.5396 5.048 19 4.4617 4.998 20 4.4258 4.945 21 4.4189 4.879 22 4.38510 4.836 23 4.25711 4.794 24 4.1212 4.73 25 3.99613 4.698作图得:由图可得T f2*=4.425℃(7)溶液第三次凝固:时间/10s温度/℃时间/10s温度/℃1 5.603 14 4.8952 5.524 15 4.8473 5.447 16 4.8184 5.381 17 4.7865 5.327 18 4.7586 5.263 19 4.7187 5.202 20 4.6918 5.15 21 4.6679 5.101 22 4.63510 5.051 23 4.6211 5.013 24 4.59412 4.974 25 4.58113 4.935 26 4.565作图得:由图可得T f3*=4.594℃三次取平均值为:T f*=4.548℃3、根据式(3),计算萘的分子量:M B=[(K f W B)/△T f W A] ×103 g/mol=[20.2/K·Kg·mol-1×0.3616g)/(6.513-4.548)K ×19.475g] ×103 g/mol=190.87g/mol经查阅,萘的摩尔质量理论值为128.17g/mol,相对误差为48.9%。
【结果与讨论】1、本次实验测得萘的摩尔质量为190.87g/mol,理论值为128.17g/mol,相对误差为48.9%。
误差相对较大。
2、实验失败的最大因素可能是搅拌。
搅拌速度的控制和温度温差仪的粗细调的固定是做好本实验的关键,每次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要完全一致。
但实验过程中没有注意到这点,由搅拌磁子在里面搅拌,整个实验过程基本保持搅拌速度一致,导致实验失败。
3、溶液的冷却曲线与纯溶剂的冷却曲线不同,不出现平台,只出现拐点,即当析出固相,温度回升到平衡温度后,不能保持一定值,因为部分溶剂凝固后,余溶液的浓度逐渐增大,平衡温度要逐渐下降。
4、每次实验测量之差不应超过0.006摄氏度,但从实验数据来看,测量的过程并不理想,这可能与仪器灵敏度有关,也与加入的溶质的量、搅拌速率有关。
5、测定溶液凝固点时,由图可知图线并不理想,凝固点不易测出,只能通过仔细观察对比原数据的变化来确定凝固点的值,这个确定过程中会有一定偏差。
影响本次实验的原因可能还有加入的萘的质量,溶质的加入量过多,溶液的凝固点降低太多,析出溶剂晶体后,溶液的浓度变化大,凝固点也随之降低,不易准确测定其凝固点。